
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。已知:Cl2+2Br-=2Cl-+Br2,2Fe2++Br2=2Fe3++2Br-,2Fe3++2I-=2Fe2++I2,则下列说法中不正确的是

A. 还原性:I-> Fe2+>Br- B. 原混合浴液中FeBr2的物质的量为3mo1
C. 线段AB表示Fe2+被氯气氧化 D. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
【答案】C
【解析】A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,选项A正确;
B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,选项B正确;C、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即线段AB表示I-被氯气氧化,选项C错误;D、由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,选项D正确。答案选C。


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
【题目】在使紫色石蕊试剂变红的溶液中,能大量共存的离子是( )
A. Na+、Ba2+、NO3-、SO42- B. Al3+、Fe3+、I-、SO42-
C. K+、Na+、Cl-、HCO3- D. Mg2+、Fe2+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe+CuSO4=Cu+FeSO4。有关该反应的说法正确的是
A. Fe是氧化剂 B. CuSO4是还原剂
C. Fe被氧化 D. CuSO4发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2016新课标Ⅱ]下列有关燃料的说法错误的是
A.燃料燃烧产物CO2是温室气体之一
B.化石燃料完全燃烧不会造成大气污染
C.以液化石油气代替燃油可减少大气污染
D.燃料不完全燃烧排放的CO是大气污染物之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①A—I均为芳香族化合物,A的分子式为C8H10O, E的分子式为C7H7Cl,I的分子式为C23H22O3 ②A的苯环上只有一个取代基,B能发生银镜反应,D的相对分子质量比C大4,E的核磁共振氢谱有3组峰
③![]() ④
④![]()
芳香酯I的合成路线如下:

请回答下列问题:
(1)A→B的反应类型为____________,E的名称为____________;
(2) B与银氨溶液反应的化学方程式为 __________________________________________;
(3) I的结构简式为_________________________________________________;
(4)符合下列要求A的同分异构体还有______________________种(不包括A);
①与Na反应并产生H2 ②芳香族化合物
(5)根据已有知识并结合相关信息,写出以CH3CH2OH为原料制备CH3CH2CH2CH2OH的合成路线流程图(无机试剂任用)_____________。合成路线流程图示例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2O(g)===H2O(l) ΔH=Q1 kJ·mol1
C2H5OH(g)===C2H5OH(l) ΔH=Q2 kJ·mol1
C2H5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=Q3 kJ·mol1
若使46 g酒精液体完全燃烧,最后恢复到室温,则放出的热量为
A.(Q1+Q2+Q3) kJ B.0.5(Q+Q2+Q3) kJ
C.(0.5Q11.5Q2+0.5Q3) kJ D.(3Q1Q2+Q3) kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验:
请回答:
(1)X的化学式是____。
(2)白色粉末溶于氢氧化钠溶液的离子方程式是____。
(3)高温条件下白色粉末与焦炭发生置换反应,写出该反应的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2 (未配平)。下列说法正确的是
Na2CrO4+Fe2O3+CO2+NaNO2 (未配平)。下列说法正确的是
A. Na2CrO4是还原产物 B. 该反应中有3种元素的化合价发生变化
C. NaNO3是还原剂 D. 1 mol FeO·Cr2O3参与反应将得到7 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在生活及工业生产中有着重要应用。请回答以下问题:
(1)下图是N2(g)、H2(g)与NH3(g)之间转化的能量关系图,则:
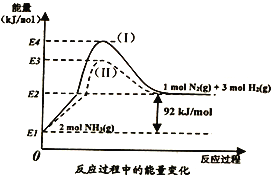
①N2(g)与H2(g)反应生成NH3(g)的热化学方程式为__________________________。
②过程(I)和过程(Ⅱ)的反应热__________(填“相同”或“不同”),原因是_______________。
③一定温度下,在容积为1L的密闭容器中充入1 mol N2(g)、3molH2(g),达到平衡时,混合气体的总量为2.8 mol,则该条件下反应 N2(g)+3H2(g)![]() 2NH3(g)的平衡常数为__________,H2的平衡转化率为__________________________。
2NH3(g)的平衡常数为__________,H2的平衡转化率为__________________________。
(2)用NH3可以消除氮氧化物的污染,已知:
反应I:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) △H1= a kJ/mol
2N2(g)+6H2O(g) △H1= a kJ/mol
反应Ⅱ:N2(g)+O2(g)![]() 2NO(g) △H2= b kJ/mol
2NO(g) △H2= b kJ/mol
反应Ⅲ:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H3= c kJ/mol
5N2(g)+6H2O(g) △H3= c kJ/mol
则:反应Ⅱ中的b=______ kJ/mol(用含a、c的代数式表示),反应Ⅲ中的△S________0(填“>”“<”或“=”)。
(3)在恒容的密闭容器中,充入一定量的NH3和NO进行上述反应Ⅲ,测得不同温度下反应体系中NH3的转化率(α)与压强p的关系如图:

①分析得P1_________P2 (填“>”“<”或“=”)。
②下列叙述中,不能判断反应Ⅲ己经达到平衡状态的标志是__________(填序号)。
a. N2的浓度不再改变 b.断裂6molN-H键的同时,有6molH-O键形成
C.容器中压强不再变化 d.混合气体的密度保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com