
| 选项 | 物质 | 杂质 | 除杂试剂 | 操作方法 |
| A | CaCl2溶液 | 稀盐酸 | 过量碳酸钙 | 过滤 |
| B | NaCl溶液 | NaBr | 稍过量氯水、乙醇 | 萃取、分液 |
| C | NaCl溶液 | Na2CO3 | 适量硝酸钙溶液 | 过滤 |
| D | O2 | CO | 氧化铜 | 通过灼热的氧化铜 |
| A. | A | B. | B | C. | C | D. | D |
科目:高中化学 来源: 题型:选择题
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 其他条件不变,减小水蒸气的浓度,正反应速率增大,逆反应速率减小 | |
| D. | 单位时间内消耗NO和N2的物质的量比为1:2时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 |
| N2浓度mol•L-1 | 4.00 | 3.70 | 3.50 | 3.36 | 3.26 | 3.18 | 3.10 | 3.00 | 3.00 | 3.00 |
| CO浓度/mol•L-1 | 0.00 | 0.90 | 1.50 | 1.92 | 2.22 | 2.46 | 2.70 | - | - | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| B. | 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分 | |
| C. | 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体 | |
| D. | 下图图片显示的是树林中的晨曦,该现象与丁达尔现象有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T | 298K | 398K | 498K | … |
| K | 4.1×106 | K1 | K2 | … |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Cu2+、Cl-、NO3- | B. | Fe2+、Na+、NO3-、Cl- | ||
| C. | K+、Na+、CO32-、SO42- | D. | K+、Na+、SO42-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
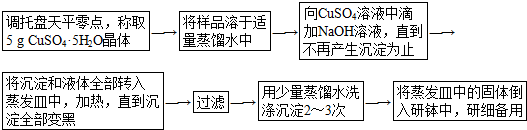
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②④ | C. | ①②③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)正=2v(CO2)逆 | B. | 密闭容器中总压强不变 | ||
| C. | 密闭容器中氨气的体积分数不变 | D. | 密闭容器中混合气体的密度不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com