
甲—辛等八种元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断不正确的是
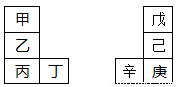
A.乙的单质在空气中燃烧生成只含离子键的化合物
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差13
D.最高价氧化物的水化物的碱性:丙>乙>甲
A
【解析】
试题分析:根据题意可知:甲是Li;乙是Na;丙是K ; 丁是Ca;戊是C,己是Si;庚是Ge;辛是Ga。A.乙的单质在空气中燃烧生成Na2O2是含离子键和非极性共价键的离子化合物,错误;B.题意周期的元素,原子序数越大,原子半径就越小,同一主族的元素,原子核外电子层数越多,原子半径就越大,所以原子半径:辛>己>戊,正确;C.丙是19号元素,庚是32号元素,因此二者的原子核外电子数相差13,正确;D. 同一主族的元素从上到下,元素的金属性逐渐增强,因此最高价氧化物的水化物的碱性就逐渐增强,故最高价氧化物的水化物的碱性:丙>乙>甲,正确。
考点:考查元素的位置、原子结构与元素形成的化合物的性质的关系的知识。


 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:2013-2014河南省周口市高一下学期6月联考化学试卷(解析版) 题型:填空题
(10分)下图是元素周期表短周期中11种元素的化台价与原子序数的关系示意图,请回答下列问题(用具体的元素符号作答):
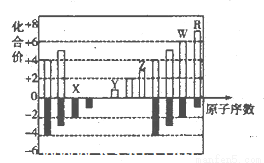
(1)元素x、Y、z、W、R五种元素中属于金属元素的是___________;Z的简单离子的结构示意图是___________。
(2)由此图可以判断,11种元素中处于同主族的共有____________组。
(3)X、Y.Z三种元素的原子半径大小顺序为___________;它们的离子的半径大小顺序为____________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:填空题
(8分)下列是八种环状的烃类物质:
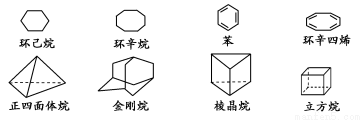
(1)金刚烷的一氯取代产物有________种,立方烷的二氯取代产物有________种。
(2)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):______________________、______________________。
(3)以立方烷的一种属于芳香烃的同分异构体为起始物质,通过一系列反应可制得苯乙炔,写出有关化学方程式(所需的试剂自选): ____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高二期终质量评估化学试卷(解析版) 题型:选择题
下列说法正确的是
A.汽油是纯净物,乙醇汽油是混合物
B.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中的“丝”和“泪”分别是蛋白质和烃
C.糖类、蛋白质在一定条件下都能发生水解反应
D.乙烯、植物油和苯都能与氢气发生加成反应,是因为其结构中都含有碳碳双键
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼
金属铝。下列说法不正确的是( )
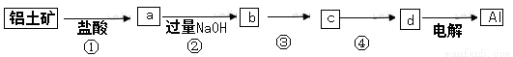
A.①、②中除加试剂外,还需要进行过滤操作
B.a、b中铝元素的化合价相同
C.③中需要通入过量的氨气
D.④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省南阳市春期高一期终质量评估化学试卷(解析版) 题型:选择题
下表中所列的都是烷烃,它们的一卤取代物均只有一种,分析下表中各项的排布规律,按此规律排布第6项应为( )
1 | 2 | 3 | 4 | 5 | …… |
CH4 | C2H6 | C5H12 | C8H18 | …… | …… |
A.C14H30 B.C17H36 C.C20H42 D.C26H54
查看答案和解析>>
科目:高中化学 来源:2013-2014河南省六市毕业班第二次联合调研检测理综化学试卷(解析版) 题型:填空题
【化学--选修3物质结构与性质】(15分)
铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
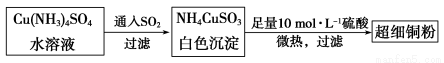
①Cu2+的价电子排布图 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②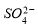 的空间构型为_____________,
的空间构型为_____________,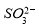 离子中心原子的杂化方式为 。
离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式: 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 .
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,
晶体中Cu原子的配位数为_______,晶体的空间利用率
为 ( 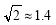 ,列式并计算结果)。
,列式并计算结果)。

查看答案和解析>>
科目:高中化学 来源:2013-2014河南师大附中高三4月份月考理综化学试卷(解析版) 题型:简答题
(13分)我国是世界上发现和使用铜及铜器最早的国家之一,直到现在铜及其化合物在工农业生产中仍然有着广泛的应用。
(1)工业上可以用黄铜矿(主要成分CuFeS2)为原料冶炼铜。主要反应如下:
① 2CuFeS2+4O2=Cu2S+3SO2+2FeO ② 2Cu2S + 3O2=2SO2+2Cu2O③ Cu2S+ 2Cu2O=6Cu+ SO2
在③中被氧化与被还原元素原子的物质的量之比为 ;若由3mol CuFeS2生成3molCu,理论上消耗O2 的物质的量为 。
(2)常温下Cu2O能溶于稀硫酸,得到蓝色溶液和红色固体,可以利用该性质检验工业上冶炼铜得到的粗铜中是否含有Cu2O,写出此反应的离子方程式 。
(3)刻蚀印刷电路的废液中含有大量的CuCl2、FeCl2、FeCl3,任意排放将导致环境污染和资源的浪费, 为了使FeCl3循环利用和回收CuCl2,现设计如下生产过程:
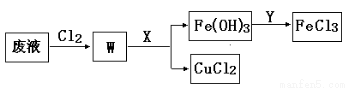
①试剂Y的名称 ;物质X最好是 (填化学式)。
②若常温下1L废液中含CuCl2、FeCl2、FeCl3的物质的量浓度均为0.5 mol· , 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2 不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38 、 KSP [Cu(OH)2]=2.0×10—20 、 lg5=0.7)
, 则加入Cl2气和物质X使溶液的pH在 范围时(设溶液体积保持不变),铁元素完全转化为Fe(OH)3,而CuCl2 不产生沉淀。( KSP [Fe(OH)3]=1.0×10—38 、 KSP [Cu(OH)2]=2.0×10—20 、 lg5=0.7)
查看答案和解析>>
科目:高中化学 来源:2013-2014河北省高二下学期第三次月考化学试卷(解析版) 题型:选择题
由—OH、—CH3、—C6H5、—COOH四种基团两两组合(包括同种基团间的组合)形成的物质中,属于有机物且水溶液显酸性的有( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com