
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | 饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释 | |
| C. | 在$\frac{{c({H^+})}}{{c(O{H^-})}}$=10-12.溶液中Na+、I-、NO3-、SO42-能大量共存 | |
| D. | 在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极 |
分析 A、氧化性Cu2+<Fe3+,铁加入溶液充分反应剩余固体一定含铜但不一定含铁;
B、氯化铁溶液中铁离子水解生成氢氧化铁和盐酸,水解过程是吸热过程,温度升高促进水解,平衡正向进行;
C、在$\frac{{c({H^+})}}{{c(O{H^-})}}$=10-12.溶液中c(H+)c(OH-)=10-14,c(H+)=10-13mol/L,为碱性溶液,离子共存;
D、原电池中电子不能通过电解质溶液;
解答 解:A、氧化性Cu2+<Fe3+,铁加入溶液充分反应,若剩余固体则一定含铜,若铁不足剩余氯化铜,则不一定含铁,故A错误;
B、氯化铁溶液中铁离子水解生成氢氧化铁和盐酸,水解过程是吸热过程,温度升高促进水解,平衡正向进行,饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,是平衡移动的结果,故B错误;
C、在$\frac{{c({H^+})}}{{c(O{H^-})}}$=10-12.溶液中c(H+)c(OH-)=10-14,c(H+)=10-13mol/L,为碱性溶液,离子键不能发生反应,离子可以共存,故C正确;
D、原电池中电子不能通过电解质溶液,是在外电路流动,故D错误;
故选C.
点评 本题考查了盐类水解分析,离子共存的分析判断,主要是离子性质和原电池原理的理解应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
 ,有关咖啡酸的说法中不正确的是( )
,有关咖啡酸的说法中不正确的是( )| A. | 咖啡酸分子式是C9H8O4 | |
| B. | 咖啡酸可以发生还原、取代、加聚等反应 | |
| C. | 1mol咖啡酸可以与4molH2发生加成反应 | |
| D. | 1mol咖啡酸最多能消耗3molNaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O、Na2O2组成元素相同,与CO2反应的产物也相同 | |
| B. | 2Na2O2+2H2O═4NaOH+O2↑,Na2O2是氧化剂H2O是还原剂 | |
| C. | Na2O2溶于水产生O2的离子方程式为:Na2O2+H2O═2Na++2OH-+O2↑ | |
| D. | Na2O2用作呼吸面具的供氧剂时氧元素既被氧化又被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3CH2CH3 | B. | CH3CH2CH2CH3 | C. | CH3CH2CH (CH3)2 | D. | CH3CH (CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
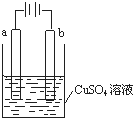
| A. | 若a和b为石墨,通电后a电极上发生的反应为Cu2++2e-═Cu | |
| B. | 若a和b为铜,通电后a电极有气体产生 | |
| C. | 若a为铜,b为铁,通电后Cu2+向a电极移动 | |
| D. | 若a为粗铜,b为纯铜,通电后b电极质量增加 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH>7的溶液中:Na+、K+、SO${\;}_{3}^{2-}$、CO${\;}_{3}^{2-}$ | |
| B. | 无色透明溶液中:H+、Ca2+、Cl-、AlO2- | |
| C. | 含大量Fe3+的溶液中:K+、I-、SO${\;}_{4}^{2-}$、NO${\;}_{3}^{-}$ | |
| D. | 与Al反应放出H2的溶液中:NH${\;}_{4}^{+}$、Na+、NO${\;}_{3}^{-}$、F- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com