
下列叙述正确的是( )
| A.同一主族的元素,原子半径越大,其单质的熔点一定越高 |
| B.同一周期元素的原子,半径越小越容易失去电子 |
| C.同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高 |
| D.稀有气体元素的原子序数越大,其单质的沸点一定越高 |
科目:高中化学 来源: 题型:单选题
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于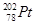 的说法正确的是
的说法正确的是
A.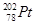 和 和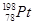 的质子数相同,互称为同位素 的质子数相同,互称为同位素 |
B.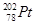 和 和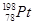 的中子数相同,互称为同位素 的中子数相同,互称为同位素 |
C.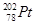 和 和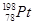 的核外电子数相同,是同一种核素 的核外电子数相同,是同一种核素 |
D.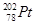 和 和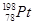 的质量数不同,不能互称为同位素 的质量数不同,不能互称为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
1911年前后,英国物理学家卢瑟福用带正电的 粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的
粒子轰击极簿的金箔。为了解释实验结果,提出了原子的核式结构学说。下列图中,黑点表示金原子核的位置,曲线ab、cd和ef表示经过金原子核附近的 粒子的运动轨迹,能正确反映实验结果的图是( )
粒子的运动轨迹,能正确反映实验结果的图是( )
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素M、X、Y、Z,其中X、Y、Z在周期表中所处的位置如图所示。M元素原子的最外层电子数为其次外层电子数的2倍。X、Y、Z三种元素原子质子数之和为32。则下列说法正确的是( )
| X | | Z |
| | Y | |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
X、Y、Z、R、W是5种短周期元素,原子序数依次增大,它们可组成离子化合物Z2Y和共价化合物RY3、XW4,已知Y、R同主族,Z、R、W同周期。下列说法不正确的是
| A.原子半径:Z>R>W |
| B.X2W6分子中各原子均满足8电子结构 |
| C.气态氢化物的稳定性:HmW>HnR |
| D.Y、Z形成的化合物中只可能存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
据报道,用10B合成的10B20有较好的抗癌作用。下列叙述正确的是
| A.10B20是一种新型化合物 | B.10B的中子数和核外电子数相等 |
| C.10B20晶体熔点高,硬度大 | D.10B和10B20互为同位素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组顺序的排列错误的是
| A.金属性:Na<Mg<Al | B.热稳定性:HCl>H2S>PH3 |
| C.酸性强弱:H4SiO4<H2CO3<HNO3 | D.熔点:金刚石>食盐>干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列各组中的性质比较,不正确的是( )
| A.稳定性:NH3<PH3<SiH4 | B.酸性:HClO4>H2SO4>H3PO4 |
| C.碱性:KOH>NaOH>Mg(OH)2 | D.还原性:F-<Cl-<Br- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com