
| A. | 铝为负极,镁为正极 | B. | 正极反应式为2H++2e-═H2↑, | ||
| C. | 放电时间越长,溶液中c(H+)越小 | D. | 电解质溶液不可能是硝酸 |
科目:高中化学 来源: 题型:解答题
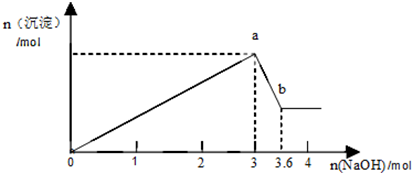
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
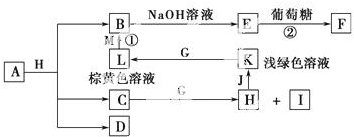
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
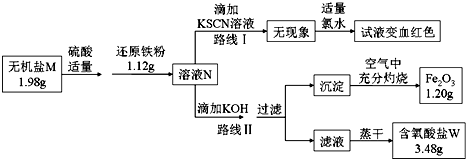
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| … | W | ||
| X | Y | … | Z |
| A. | 离子半径:X>Y>Z>W | |
| B. | 气态氢化物的稳定性W>Z | |
| C. | 元素X与Z形成的化合物中只含有离子键 | |
| D. | 最高价氧化物对应水化物的碱性X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌作阳极,铁制品作阴极,溶液中含有锌离子 | |
| B. | 锌作阴极,铁制品作阳极,溶液中含有锌离子 | |
| C. | 锌作阳极,铁制品作阴极,溶液中含有亚铁离子 | |
| D. | 锌作阴极,铁制品作阳极,溶液中含有亚铁离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液具有漂白性是因为空气中的CO2与消毒液中的NaClO反应生成HClO | |
| B. | “乙醇汽油”是向汽油中添加了一定比例的乙醇,该混合燃料的热值也发生了改变 | |
| C. | 用聚乳酸塑料代替聚乙烯塑料可减少白色污染 | |
| D. | 丝绸和棉花的组成元素相同,分子结构不同,因而性质不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com