
| A. | 用浓H2SO4刻蚀工艺玻璃上的纹饰 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的 | |
| D. | 制饭勺、饭盒、高压锅等的不锈钢是合金 |
分析 A.浓硫酸与玻璃不反应;
B.光导纤维主要成分是二氧化硅;
C.漂白粉生成具有强氧化性的次氯酸,明矾水解生成具有吸附性的氢氧化铝;
D.合金就是某种金属与其他一种或几种金属或非金属融合在一起形成的混合物.
解答 解:A.浓硫酸与玻璃不反应,不能雕刻玻璃,氢氟酸能够与玻璃中二氧化硅反应,可以用来雕刻玻璃,故A错误;
B.二氧化硅用于制作光导纤维,故B错误;
C.漂白粉生成具有强氧化性的次氯酸,明矾水解生成具有吸附性的氢氧化铝,二者原理不同,故C错误;
D.“不锈钢是合金”,不锈钢是铁、钴、镍的合金,故D正确;
故选:D.
点评 本题考查了生活中的化学,熟悉玻璃的成分及性质、二氧化硅、漂白粉、明矾的性质、合金的概念是解题关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
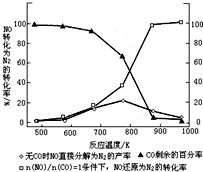 乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:
乙醇汽油是被广泛使用的新型清洁燃料,工业生产乙醇的一种反应原理为:| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
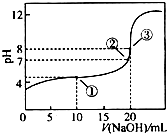 在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )
在25℃时,向50.00mL未知浓度的CH3COOH溶液中逐滴加入0.5mol•L-1的NaOH溶液.滴定过程中,溶液的pH与滴入NaOH溶液体积的关系如图所示,则下列说法中,不正确的是( )| A. | 该滴定过程可采用酚酞做指示剂 | |
| B. | 图中点③所示溶液中,c(CH3COO-)<c(Na+) | |
| C. | 图中点①所示溶液中水的电离程度大于点③所示溶液中水的电离程度 | |
| D. | 滴定过程中的某点,会有c(Na+)=c(CH3COO-)>c(H+)=c(OH-)的关系存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ZnCl2溶液 | B. | NaCl溶液 | C. | CaCl2溶液 | D. | FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高纯度的单晶硅用于制造光导纤维 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 乙酸乙酯在碱性条件下水解称为皂化反应 | |
| D. | 可溶性铜盐有毒,在生命体中铜是一种不可缺少的微量元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O;
+3H2O;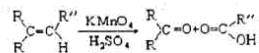

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠存放在盛有煤油的试剂瓶中 | |
| B. | 烧碱盛放在玻璃瓶塞的磨口玻璃瓶中 | |
| C. | 存放液溴的试剂瓶中应加水封 | |
| D. | 漂白粉置于冷暗处密封保存 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com