
(12分)(1)在硫酸工业生产中,我国采用黄铁矿为原料 生产SO2,反应的化学方程式为: ,该反应在 中进行。
(2)为了有利于SO2的转化为SO3,且能充分利用热能,采 用 了多层催化剂间有热交换器的接触室(见图)。按此密闭体系中气体的流向,则C处流出的气体为 ,A、B、C三处气体的温度由高到低的顺序为 。

(3)在吸收塔中用 吸收SO3,从吸收塔上部导出的气体再次通入 ,进行第二次氧化,再进行一次吸收后将尾气中很少的SO2净化回收,以防污染大气。
科目:高中化学 来源:2010-2011学年江苏省淮安五校高二上学期期末考试化学试卷 题型:填空题
(12分)下图是元素周期表中的一部分。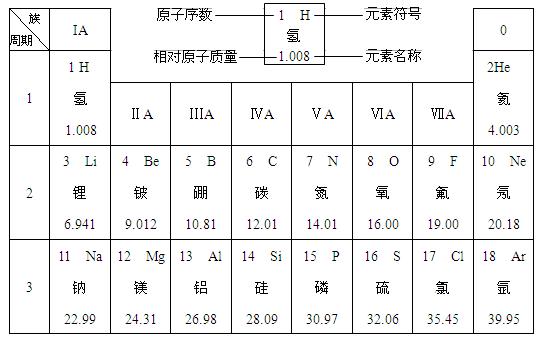
在元素周期表中,同一周期(横行)中的元素,除0族(最右纵行)元素外,从左到右原子序数依次增多,原子半径逐渐减小,在化学反应中,原子失电子能力逐渐减弱,得电子能力逐渐增强。
请回答:
(1)硅的相对原子质量为 ;原子序数为8的元素位于元素周期表的第 周期,元素符号为 ,它属于 (填“金属”或“非金属”)元素。
(2)原子半径:钠 镁(填“>”或“=”或“<”,下同),原子得电子能力:硫 氯。
查看答案和解析>>
科目:高中化学 来源:2015届江苏省江宁分校高二上学期选修期末化学试卷(解析版) 题型:实验题
(共12分)过氧化氢是重要的氧化剂、还原剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的浓度, 请填写下列空白:
(1)将10.00 mL过氧化氢溶液至250mL ___________(填仪器名称)中,加水稀释至刻度,摇匀。移取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
(2)用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数和化学式分别填在下列横线和括号内。
MnO4- + H2O2 + H+ == Mn2+ + O2 + ( )
(3)移取10mL过氧化氢溶液可以用_________________(填“酸式”或“碱式”)滴定管。不用碱式滴定管盛装KMnO4标准液的原因是 ,滴定到达终点的现象是__________ _____________。
(4)重复滴定三次,平均耗用c mol/L KMnO4标准溶液V mL,则原过氧化氢溶液中过氧化氢的浓度为_________________________________。
(5)若盛装高锰酸钾标准溶液的滴定管用蒸馏水洗后没有用标准液润洗,则测定结果_________(填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省宜宾市高三第一次诊断性测试化学试卷(解析版) 题型:填空题
(12分)工业制硫酸时,利用接触氧化反应将SO2转化为SO3是一个关键的步骤。
(1)在接触室中2SO2(g)+O2(g)
 2SO3(g)达到平衡状态的标志是______。
2SO3(g)达到平衡状态的标志是______。
A.υ(O2)正=2υ(SO2)逆
B.容器中气体的总质量不随时间而变化
C.容器中气体的颜色不随时间而变化
D.容器中气体的压强不随时间而变化
(2)下列关于反应2SO2(g)+O2(g)
 2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。
2SO3(g)
ΔH<0。下列图像中不正确的是______ (填字母序号)。

(3)某温度下SO2(g)+ 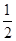 O2(g)
O2(g)
 SO3(g)
ΔH=-98KJ/mol
SO3(g)
ΔH=-98KJ/mol
①开始时在体积固定的密闭容器中加入4mol SO2 (g)和1mol O2 (g),达到平衡时 共放出196 KJ的热量,该温度下SO2的平衡转化率为______
②已知固态单质硫的燃烧热为296KJ/mol,则由S(s)生成2 molSO3(g)的ΔH为____________
(4)检验SO42-常用BaCl2溶液。常温时,BaSO4的Ksp=1.08×10-10,现将等体积的 BaCl2溶液与2.0×10-3mol/L的H2SO4溶液混合。若要生成BaSO4沉淀,原BaCl2溶液的最小浓度为____________
查看答案和解析>>
科目:高中化学 来源:2014届广东省汕头市高二10月月考化学试卷(解析版) 题型:填空题
(12分)写出下列反应的热化学方程式。
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g) ΔH=+64.39kJ/mol
2H2O2(l)=2H2O(l)+O2(g) ΔH=-196.46kJ/mol
H2(g)+1/2 O2(g)=H2O(l) ΔH=-285.84kJ/mol
在H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 。
(2)在298K下,C、Al的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,Al能将C从CO2置换出来,写出此置换反应的热化学方程式
(3)25℃,1.01×105Pa下,1g 硫粉在氧气中充分燃烧放出 9.36kJ热量,写出表示硫燃烧热的热化学方程式
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省南通市通州区高三4月查漏补缺专项检测化学试卷(解析版) 题型:计算题
(12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) SO2Cl2(l)
△H=—97.3kJ/mol
SO2Cl2(l)
△H=—97.3kJ/mol
⑴为了提高上述反应中Cl2的平衡转化率,下列措施合理的是 (用编号填空)。
A.缩小容器体积 B.使用催化剂 C.增加SO2浓度 D.升高温度
(2)300℃时,体积为1 L的密闭容器中充入16.20 g SO2Cl2,达到平衡时容器中含SO2 7.616 g,则300℃时合成SO2Cl2反应的平衡常数为 。
(3)已知某温度下,已知Ksp(AgCl)=2.0×10-10,Ksp(Ag2SO4)=1.6×10-5,在SO2Cl2溶于水所得溶液中逐滴加入AgNO3稀溶液,当Ag+浓度为0.1mol/L时,浑浊液中Cl-浓度与SO42- 浓度之比为 。
⑷将(2)所得的平衡混合气溶于足量的BaCl2溶液中,计算最终生成沉淀的质量是多少(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com