
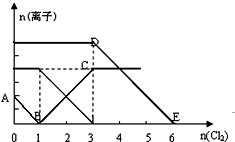
 向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示.有关说法正确的是( )| A. | 线段BC代表Cl-数目的变化情况 | |
| B. | 原混合溶液中c(FeBr2)=6mol/L | |
| C. | 当通入Cl22mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2→2Fe3++I2+4 Cl- | |
| D. | 原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
分析 还原性为I->Fe2+>Br-,则先发生2I-+Cl2═I2+2Cl-,I-反应完毕再发生2Fe2++Cl2═2Fe3++2Cl-,最后发生反应2Br-+Cl2═Br2+2Cl-,
A.B点时溶液中I-完全反应,溶液中存在Fe2+和Br-,BC段发生2Fe2++Cl2═2Fe3++2Cl-;
B.根据BC段消耗的氯气的物质的量,计算溶液n(Fe2+);
C.根据反应消耗顺序,利用消耗的氯气计算参加反应的离子的物质的量;
D.根据各阶段消耗的氯气的物质的量,计算原溶液中n(Fe2+)、n(I-)、n(Br-).
解答 解:还原性为I->Fe2+>Br-,则先发生2I-+Cl2═I2+2Cl-,I-反应完毕再发生2Fe2++Cl2═2Fe3++2Cl-,最后发生反应2Br-+Cl2═Br2+2Cl-,
A.B点时溶液中I-完全反应,溶液中存在Fe2+和Br-,BC段发生2Fe2++Cl2═2Fe3++2Cl-,代表Fe3+的物质的量的变化情况,而不是氯离子,故A错误;
B.由图可知,BC段发生2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕消耗氯气2mol,由方程式可知n(Fe2+)=2×2mol=4mol,则n(FeBr2)=4mol,故B错误;
C.AB段发生2I-+Cl2═I2+2Cl-,2mol的I-消耗1mol氯气,BC段发生2Fe2++Cl2═2Fe3++2Cl-,余下的1mol氯气再与2molFe2+反应,故参加反应的n(Fe2+):n(I-)=1:1,故通入2molCl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-,故C正确;
D.由图可知AB段消耗氯气1mol,发生2I-+Cl2═I2+2Cl-,故n(I-)=2n(Cl2)=2mol,BC段发生2Fe2++Cl2═2Fe3++2Cl-,消耗氯气2mol,故n(Fe2+)=2n(Cl2)=2×2mol=4mol,DE段发生2Br-+Cl2═Br2+2Cl-,消耗氯气3mol,故n(Br-)=2n(Cl2)=6mol,故原溶液中n(Fe2+):n(I-):n(Br-)=4mol:2mol:6mol=2:1:3,故D正确;
故选CD.
点评 本题以图象形式考查氧化还原反应、化学计算,综合性较强,根据离子的还原性强弱结合图象判断各阶段发生的反应是解答该题的关键,为易错题目,题目难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铁和稀硫酸反应:Fe2O3+6H+=2Fe2++3H2O | |
| B. | 碳酸氢钠溶液中加稀硫酸:CO32-+2H+=H2O+CO2↑ | |
| C. | 氢氧化钡溶液加入稀硫酸中:OH-+H+ H2O | |
| D. | Cu(OH)2加入H2SO4:2H++Cu(OH)2=Cu2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | S+O2═2SO2;△H=-269kJ/mol(反应热) | |
| B. | 2NO2(g)═O2(g)+2NO(g);△H=+116.2kJ/mol(反应热) | |
| C. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0kJ/mol(燃烧热) | |
| D. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 盐酸的物质的量浓度为1 mol•L-1,配制100 mL该溶液可用图3装置进行 | |
| B. | P点时反应恰好完全,溶液呈中性 | |
| C. | 曲线a是氢氧化钠溶液滴定盐酸的滴定曲线,可在图2的装置中进行 | |
| D. | 如果锥形瓶用待测液润洗,会使测定结果偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
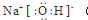 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com