
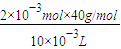 =8g/L.
=8g/L.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:郑州国华学校2009-2010年高三上学期第一次月考化学试题 题型:013
|
为检验某病人血液中的含钙量,现取10 mL血液样品稀释后用草酸铵[(NH4)2C2O4]处理成草酸钙沉淀,将此沉淀溶于过量的稀H2SO4中,然后用0.5 mol/L KMnO4溶液(生成Mn2+、CO2、H2O)恰好消耗1.6 mL,则该病人血液中含钙量为 | |
| [ ] | |
A. |
2.4 g/L |
B. |
8 g/L |
C. |
6 g/L |
D. |
12 g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[![]() ]处理成草酸钙沉淀,将此沉淀溶于过量的稀
]处理成草酸钙沉淀,将此沉淀溶于过量的稀![]() 中,然后用
中,然后用![]() 溶液(生成
溶液(生成![]() 、
、![]() 、
、![]() )恰好消耗1.6mL,则该病人血液中含钙量为( )
)恰好消耗1.6mL,则该病人血液中含钙量为( )
A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.4 g/L | B.8 g/L | C.6 g/L | D.12 g/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com