
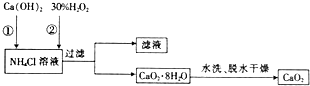
分析 (1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应前后元素化合价变化分析判断是否为氧化还原反应;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵;
(3)实验室用硝酸酸化的硝酸银溶液检验是否含氯离子检验是否洗涤干净;
(4)CaO2能和水反应,氧气能抑制CaO2分解;
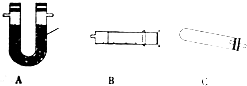
(5)①利用这种C加热固体超氧化钙生成过氧化钙和氧气,通过这种A吸收水蒸气,通过这种B测定生成氧气的体积;
②组装好装置,利用装置内压强改变,注射器中活塞移动来判断装置气密性;
③根据过氧化钙和氧气之间的关系式计算.
解答 解:(1)第②步反应中,氯化钙、双氧水、一水合氨和水反应生成CaO2•8H2O和氯化铵,反应方程式为CaCl2+H2O2+2NH3•H2O+6H2O=CaO2•8H2O↓+2NH4Cl,反应过程中无元素化合价的变化,不属于氧化还原反应,
故答案为:不属于;
(2)第①步中氯化铵参加反应、第②步中生成氯化铵,所以可以循环使用的物质是NH4Cl,
故答案为:NH4Cl;
(3)实验室用硝酸酸化的硝酸银溶液检验,如果沉淀没有洗涤干净,向洗涤液中加入硝酸酸化的硝酸银溶液应该有白色沉淀,其检验方法是:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净,
故答案为:取少量最后一次洗涤上清液,然后向洗涤液中加入少量硝酸酸化的硝酸银溶液,观察溶液是否产生白色沉淀,如果产生白色沉淀就证明没有洗涤干净,否则洗涤干净;
(4)CaO2能和水、二氧化碳反应,与水生成氢氧化钙和氧气,与二氧化碳反应生成碳酸钙和氧气,CaO2在350℃迅速分解生成CaO和O2,所以通入氧气能抑制超氧化钙分解;
故答案为:防止过氧化钙和二氧化碳反应;
(5)①利用这种C加热固体超氧化钙生成过氧化钙和氧气,通过这种A吸收水蒸气,通过这种B测定生成氧气的体积,装置连接的顺序为CAB,装置A中是固体干燥剂可以用碱石灰干燥氧气,
故答案为:CAB;碱石灰;
②组装好装置,微热装置C针管活塞外移,冷却后恢复到原来的位置,表明装置气密性完好,
故答案为:微热装置C针管活塞外移,冷却后恢复到原来的位置,表明装置气密性完好;
③设超氧化钙质量为x,
2CaO2$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑
144g 22.4L
x 10-3VL
144g:22.4L=x:10-3VL
x=$\frac{144g×1{0}^{-3}VL}{22.4L/mol}$=$\frac{144V}{22400}$g=$\frac{9V}{1400}$,
其质量分数=$\frac{\frac{9V}{1400}g}{mg}$×100%=$\frac{9V}{1400}$×100%,
故答案为:$\frac{9V}{1400}$×100%.
点评 本题考查制备实验方案评价,为高频考点,侧重考查离子检验、实验基本操作、物质含量测定等知识点,明确实验原理及物质性质是解本题关键,难点是题给信息的挖掘和运用,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未加NaOH溶液时:c(H+)>c(Cl-)=c(CH3COOH) | |
| B. | 加入l0mLNaOH溶液时:c(CH3COO-)+c(OH-)=c(H+) | |
| C. | 加入20mLNaOH溶液时:c(Na+)=c(CH3COOH)+c(CH3COO一) | |
| D. | 加入20mLNaOH溶液时,酸碱恰好中和:c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1的NaOH溶液中:K+、Na+、SO42-、CO32- | |
| B. | 0.1 mol•L-1的Na2CO3溶液中:K+、Ba2+、NO3-、Cl- | |
| C. | 0.1 mol•L-1的FeCl3溶液中:K+NH4+、I-、SCN- | |
| D. | 0.1 mol•L-1的盐酸中:Fe2+、Na+、Br-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
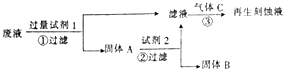 如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )
如图是处理蚀刻电路板废液(含有FeCl2、FeCl3、CuCl2)回收FeCl3溶液的方案,下列有关说法正确的是( )| A. | 试剂1可以是铁也可以是铜 | |
| B. | 试剂2可以是盐酸也可以是硫酸 | |
| C. | 气体C为Cl2,不能用H2O2替换 | |
| D. | 步骤①②③中发生的反应均为氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨、液氯、干冰、碘化银均为化合物 | |
| B. | 明矾、小苏打、醋酸、次氯酸均为电解质 | |
| C. | 碘酒、牛奶、豆浆、漂白粉均为胶体 | |
| D. | Na2O2、Na2CO3、Na2SiO3、KNO3均为盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2CO3比NaHCO3易溶于水 | |
| B. | NaHCO3比Na2CO3稳定 | |
| C. | 澄清的石灰水能与Na2CO3反应,不与NaHCO3反应 | |
| D. | 等物质的量的Na2CO3和NaHCO3与等浓度足量的盐酸反应,消耗盐酸体积之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
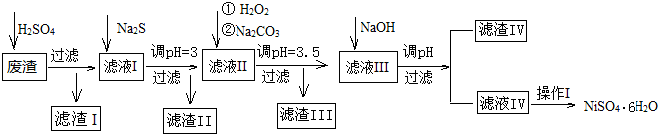
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | CuS | ZnS | FeS | NiS | Al(OH)3 | Mg(OH)2 | Ni(OH)2 |
| pH | 3.2 | 9.7 | ≥-0.42 | ≥2.5 | ≥7 | ≥7.5 | ≥5 | ≥8 | ≥8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单氢化物的热稳定性:Z>W | B. | 最高价氧化物的水化物的酸性:X<Z | ||
| C. | 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X) | D. | 沸点:XW2>Y2W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com