
已知:2Fe2++Br2═2Fe3++2Br﹣,2Fe3++2I﹣═2Fe2++I2.向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.下列有关说法中,不正确的是( )
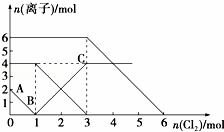
A. 还原性:I﹣>Fe2+>Br﹣
B. 原混合溶液中FeBr2的物质的量为6 mol
C. 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣
D. 原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=2:1:3
考点: 离子方程式的有关计算.
分析: 首先根据氧化还原反应中:氧化剂的氧化性>氧化产物的氧化性,还原剂的还原性>还原产物的还原性,氧化剂先氧化还原性强的离子,再氧化还原性弱的离子,判断离子的反应先后顺序,然后根据图象判断参加反应的各离子的物质的量,
A.在氧化还原反应中还原剂的还原性强于还原产物的还原性,则根据方程式可知还原性:I﹣>Fe2+>Br﹣;
B.氯气首先氧化碘离子,然后是亚铁离子,最后是溴离子,根据图象可知原混合溶液中碘离子是2mol、亚铁离子是4mol,溴离子是6mol,则FeBr2的物质的量为3 mol;
C.当通入2 mol Cl2时碘离子完全被氧化,亚铁离子一半被氧化,溶液中已发生的离子反应可表示为:2Fe2++2I﹣+2Cl2═2Fe3++I2+4Cl﹣;
D.根据以上分析可知原溶液中:n(Fe2+):n(I﹣):n(Br﹣)=2:1:3.
解答: 解:A.反应2Fe2++Br2=2Fe3++2Br﹣中,还原剂Fe2+的还原性强于还原产物Br﹣,所以还原性:Fe2+>Br﹣,反应2Fe3++2I﹣=2Fe2++I2中,还原剂I﹣的还原性强于还原产物Fe2+,所以还原性:I﹣>Fe2+,所以还原性:I﹣>Fe2+>Br﹣,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;
C.当通入2molCl2时,2mol的I﹣消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为:2Fe2++2I﹣+2Cl2=2Fe3++I2+4Cl﹣,故C正确;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,则n(Fe2+):n(I﹣):n(Br﹣)=2:1:3,故D正确.
故选B.
点评: 本题考查氧化还原反应中氧化性和还原性强弱的知识,综合性较强,题目难度中等,解答本题时注意根据离子的还原性强弱结合图象判断反应的先后顺序和各离子的物质的量,为解答该题的关键,也是易错点.


科目:高中化学 来源: 题型:
下列关于Na和Na+性质的叙述正确的是( )
A. 它们都显碱性
B. 它们都有强还原性
C. 它们都能跟H2O、O2反应
D. Na只有还原性,Na+只有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的铝分别与等物质的量浓度的稀盐酸、氢氧化钠溶液反应,放出的气体在标准状况下体积相等,则所取稀盐酸和氢氧化钠溶液的体积比为( )
A. 3:1 B. 3:2 C. 1:2 D. 6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期元素的离子:aA2+、bB+、cC3﹣、dD﹣都具有相同的电子层结构,则下列叙述正确的是( )
A. 原子半径 A>B>D>C B. 原子序数 d>c>b>a
C. 离子半径 C>D>B>A D. 单质的还原性 A>B>D>C
查看答案和解析>>
科目:高中化学 来源: 题型:
下列与化学反应能量变化相关的叙述正确的是()
A. 生成物总能量一定低于反应物总能量
B. 放热反应的反应速率总是大于吸热反应的反应速率
C. 应用盖斯定律,可计算某些难以直接测量的反应焓变
D. 同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H不同
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①1mol H2分子中化学键断裂时需要吸收436kJ的能量
②1mol Cl2分子中化学键断裂时需要吸收243kJ的能量
③由H原子和Cl原子形成1mol HCl分子时释放431kJ的能量
下列叙述正确的是()
A. 氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g)
B. 氢气和氯气反应生成2mol氯化氢气体,反应的△H=183kJ/mol
C. 氢气和氯气反应生成2mol氯化氢气体,反应的△H=﹣183kJ/mol
D. 氢气和氯气反应生成1mol氯化氢气体,反应的△H=﹣183kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
对于固定体积的密闭容器中进行的气体反应可以说明A(g)+B(g)⇌C(g)+D(g)在恒温下已达到平衡的是()
A. 反应容器的压强不随时间而变化
B. A气体和B气体的生成速率相等
C. A、B、C三种气体的生成速率相等
D. 反应混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关叙述中正确的是( )
|
| A. | 难溶于水的电解质一定是弱电解质 |
|
| B. | 强电解质在水溶液中的电离过程是不可逆的 |
|
| C. | 易溶于水的电解质一定是强电解质 |
|
| D. | 强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com