
【题目】为检验某加碘食盐中是否含有![]() ,取相同食盐样品进行下表所示实验:下列说法中正确的是
,取相同食盐样品进行下表所示实验:下列说法中正确的是
(已知:![]() )
)
实验① | 实验② | 实验③ |
|
|
|
振荡,溶液迅速变为蓝色 | 振荡,一段时间后溶液变为浅蓝色 | 振荡,溶液变为浅黄色 |
A.仅由实验①就能证明食盐样品中存在![]()
B.实验②中发生反应的离子方程式为![]()
C.实验③能证明食盐样品中不存在![]()
D.以上实验说明离子的还原性:![]()
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
【题目】4种短周期元素W、X、Y、Z的原子序数依次增大,其原子的最外层电子数之和为19,W和X元素原子内质子数之比为1:2,X2+和Z-离子的电子数之差为8,下列说法不正确的是 ( )
A. 与W相邻的同主族元素可制成重要的半导体材料
B. X单质不可能置换出W单质
C. 元素原子半径从大到小的顺序是X、Y、Z
D. W、Y、Z元素最高价氧化物对应的水化物中酸性最强的是HZO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:3X(g)+2Y(s)![]() 2Z(g)+W(g) △H>0,下列叙述错误的是
2Z(g)+W(g) △H>0,下列叙述错误的是
A. 升高温度,正逆反应速率都增大
B. 若单位时间内每消耗3molX的同时消耗2molZ,则反应达到化学平衡状态
C. 适当增大压强,化学平衡不发生移动
D. 平衡时,X与W的物质的量浓度之比一定为3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有3种元素的基态原子的电子排布式如下:①![]() ,②
,②![]() ,③
,③![]() 。则下列有关比较中正确的是
。则下列有关比较中正确的是
A.第一电离能:③>②>①B.原子半径:①>②>③
C.电负性:③>②>①D.最高正化合价:②>①>③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有①、②、③、④四种元素的基态原子的电子排布式如下:①![]() ;②
;②![]() ;③
;③![]() ;④
;④![]() 。则下列有关比较中不正确的是
。则下列有关比较中不正确的是
A.电负性:④>③>②>①
B.最高正化合价:③>②>①>④
C.原子半径:①>②>③>④
D.第一电离能:④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧ag液态乙醇生成二氧化碳气体和液态水,放出QkJ热量,经测定ag液态乙醇与足量钠 反应生成标准状况下5.6L氢气。则液态乙醇燃烧的热化学方程式表示正确的是( )
A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-QkJ·mol-1
B.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) ΔH=-2QkJ·mol-1
C.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=-2QkJ·mol-1
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH=+QkJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】异丁烯与氯化氢可能发生的两种加成反应及相应的能量变化与反应过程如下图所示,下列说法错误的是( )


A.活化能:反应①大于反应②
B.中间产物的稳定性:中间体1小于中间体2
C.产物的能量:产物1大于产物2
D.△H大小:反应①小于反应②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A为原料合成有机物F和I的合成路线如下:
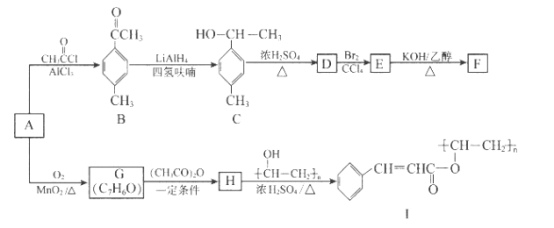
已知:R-CHO+(CH3CO)2O![]() R-CH=CHCOOH+CH3COOH
R-CH=CHCOOH+CH3COOH
(1)A的分子式为_________,C中的官能团名称为_____________。
(2)D分子中最多有________________个原子共平面。
(3)E生成F的反应类型为________________,G的结构简式为________________。
(4)由H生成I的化学方程式为:______________。
(5)符合下列条件的B的同分异构体有多种,其中核磁共振氢谱为4组峰,且面积比为6:2:1:1的是(写出其中一种的结构简式) ________________。
①属于芳香化合物;②能发生银镜反应
(6)己知RCOOH![]() RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备
RCOCl,参照上述合成路线,以苯和丙酸为原料(无机试剂任选),设计制备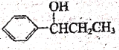 的合成路线。
的合成路线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-硝基-1,3-苯二酚是重要的医药中间体。实验室常以间苯二酚为原料分以下三步合成:
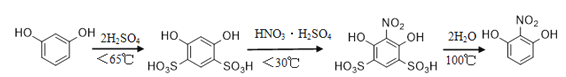
部分物质相关性质如下表:
名称 | 相对分子质量 | 性状 | 熔点/℃ | 水溶性(常温) |
间苯二酚 | 110 | 白色针状晶体 | 110.7 | 易容 |
2-硝基-1,3-苯二酚 | 155 | 桔红色针状晶体 | 87.8 | 难容 |
制备过程如下:
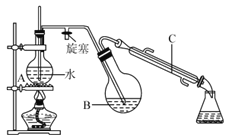
①磺化:称取71.0g碾成粉状的间苯二酚放入烧杯中,慢慢加入浓硫酸并不断搅拌,控制温度为60℃~65℃约15min,如下图。
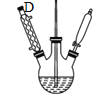
②硝化:将烧杯置于冷水中冷却后加入混酸,控制温度(25±5)℃左右继续搅拌15min。
③蒸馏:将硝化反应混合物移入圆底烧瓶B中,然后用左图所示装置进行水蒸气蒸馏;将馏出液冷却后再加入乙醇![]() 水混合剂重结晶。
水混合剂重结晶。
回答下列问题:
(1)图中仪器C的名称是______。
(2)磺化和硝化过程中装置D的作用是______。
(3)硝化过程中控制温度(25±5)℃左右,温度不宜过高,原因是______。
(4)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故、又能______。反应一段时间后,停止蒸馏,此时应______(填标号)。
A.打开活塞![]() 熄灭酒精灯
熄灭酒精灯![]() 停止通冷凝水
停止通冷凝水
B.熄灭酒精灯![]() 打开活塞
打开活塞![]() 停止通冷凝水
停止通冷凝水
C.熄灭酒精灯![]() 停止通冷凝水
停止通冷凝水![]() 打开活塞
打开活塞
D.停止通冷凝水![]() 打开活塞
打开活塞![]() 熄灭酒精灯
熄灭酒精灯
(5)步骤③蒸馏所得2-硝基-1,3-苯二酚中仍含少量杂质,可用少量乙醇![]() 水混合剂洗涤。请设计简单的证明2-硝基-1,3-苯二酚已经洗涤干净______。
水混合剂洗涤。请设计简单的证明2-硝基-1,3-苯二酚已经洗涤干净______。
(6)水蒸气蒸馏是分离和提纯有机物的方法之一,被提纯的物质必须具备的条件正确的是______(填标号)。
a.不溶或难溶于水,便于最后分离 b.在沸腾下与水不发生化学反应
c.具有一定的挥发性 d.具有较低的熔点
(7)本实验最终获得12.0g桔红色晶体,则2-硝基-1,3-苯二酚的产率约为______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com