
(2)一个完整的氧化还原反应可以拆写成两个半反应,一个是氧化反应,一个是还原反应,如2Fe3++Cu====2Fe2++Cu2+,拆开的结果是:氧化反应Cu-2e-====Cu2+,还原反应2Fe3++2e-====2Fe2+,据此请把![]() +5Fe2++8H+====Mn2++5Fe3++4H2O拆写成两个半反应:
+5Fe2++8H+====Mn2++5Fe3++4H2O拆写成两个半反应:
氧化反应:__________________________________;
还原反应:__________________________________。
科目:高中化学 来源: 题型:
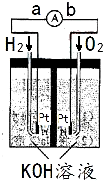 (2009?福州模拟)氢氧燃料电池是符合绿色化学理念的新型发电装置.右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(2009?福州模拟)氢氧燃料电池是符合绿色化学理念的新型发电装置.右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
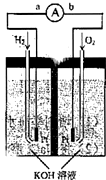 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
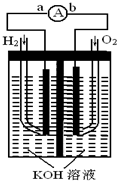 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢氧燃料电池是符合绿色化学理念的新型发电装置,右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置,右图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答:
查看答案和解析>>
科目:高中化学 来源: 题型:
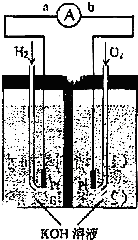 氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com