
【题目】利用下列实验装置进行相应的实验(部分夹持装置略去),不能达到实验目的的是

A. 利用图甲装置可快速制取少量氨气
B. 利用图乙装置分离水和溴的苯溶液
C. 利用图丙装置蒸发KCl溶液得晶体
D. 图丁装置中溶液颜色变浅,说明SO2具有漂白性
【答案】D
【解析】图甲装置中浓氨水中存在以下平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-,加入固态碱性物质,(如CaO、NaOH、碱石灰等),使平衡逆向移动,同时反应放热,促进NH3·H2O的分解,A项正确;溴易溶于苯且苯与水互不相溶,故可以采用图乙装置分离水和溴的苯溶液,B项正确;KCl溶液通过蒸发结晶可得KCl晶体,C项正确;SO2具有还原性,能与高锰酸钾溶液发生氧化还原反应,故图丁装置中溶液颜色变浅,说明SO2具有还原性,D项错误。
NH4++OH-,加入固态碱性物质,(如CaO、NaOH、碱石灰等),使平衡逆向移动,同时反应放热,促进NH3·H2O的分解,A项正确;溴易溶于苯且苯与水互不相溶,故可以采用图乙装置分离水和溴的苯溶液,B项正确;KCl溶液通过蒸发结晶可得KCl晶体,C项正确;SO2具有还原性,能与高锰酸钾溶液发生氧化还原反应,故图丁装置中溶液颜色变浅,说明SO2具有还原性,D项错误。
溶液 | 石蕊试液 | 加有酚酞的 NaOH溶液 | 酸性KMnO4 溶液 | 溴水 | 品红 溶液 | 氢硫酸 (H2S溶液) |
现象 | 变红 | 褪色 | 褪色 | 褪色 | 褪色 | 生成浅黄色沉淀 |
性质 | 酸性氧化物 | 酸性氧化物 | 还原性 | 还原性 | 漂白性 | 氧化性 |


科目:高中化学 来源: 题型:
【题目】电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为:______________________________________,该过程中调节溶液的pH为5,则c(Fe3+)为:____________mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
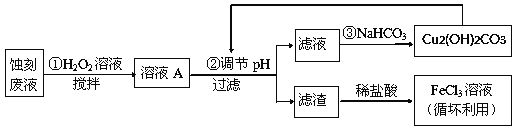
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有:_______________。
②FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是:_________________。
③步骤①中加入H2O2溶液的目的是:______________________________________。
④已知:生成氢氧化物沉淀的pH
Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 4.7 | 7.0 | 1.9 |
沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是:________________。
⑤写出步骤②中生成CO2的离子方程式:__________(已知Cu2(OH)2CO3难溶于水)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,回答下列问题:
(1)还原产物是
(2)氧化剂与还原剂的物质的量之比是
(3)用双线桥标上电子转移的方向和数目 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:
Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
盐酸液的体积(mL) | 30 | 30 | 30 | 30 |
样品(g) | 2.26 | 3.39 | 5.65 | 6.78 |
二氧化碳的体积(mL) | 448 | 672 | 784 | 672 |
(1)由以上数据,可以推测用1.13g样品进行同样的实验时,产生CO2______mL(标准状况).
(2)另取2.26g天然碱样品于300℃加热分解至完全(300℃时NaCO3不分解),产生CO2 112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式_________.
(3)依据上表所列数据以及天然碱的化学式,试求盐酸的浓度_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KI+5KIO3+3H2S=3I2+3K2SO4+3H2O,下列说法正确的是( )
A.氧化剂和还原剂物质的量之比为5:4
B.3 mol H2S可还原4mol的KIO3
C.I2是还原产物,K2SO4是氧化产物
D.1molKIO3可氧化0.2mol的KI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下有:①6.72L CH4 , ②3.01×1023个HCl分子,③13.6g H2S,④0.2mol NH3 . 下列对这四种气体的描述不正确的是( )
A.体积 ②>③>①>④
B.密度 ②>③>④>①
C.质量 ②>③>④>①
D.氢原子个数 ①>③>④>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Al2(SO4)3溶液中,含Al3+为1.62g,在该溶液中加入0.1mol/L Ba(OH)2溶液300mL,反应后溶液中SO42﹣的物质的量的浓度为( )(混合体积看成两液体体积之和)
A.0.4mol/L
B.0.3mol/L
C.0.2mol/L
D.0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)固体氧化物燃料电池的工作原理如图所示,已知电池中电解质为熔融固体氧化物,O2-可以在其中自由移动。当燃料气为C2H4时,其正极、负极反应式分别为

正极:______________________;
负极:____________________。
(2)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用如图所示装置模拟上述过程,则Co2+在阳极的电极反应式为__________________;除去甲醇的离子方程式为___________。
(3)如图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

①环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为______________________;
②若生成4.29 g Cu2(OH)3Cl,则理论上耗氧气体积为___________L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.芳香烃主要来源于分馏煤焦油和石油的催化重整
B.苯的同系物均可被酸性高锰酸钾溶液氧化
C.含苯环的烃都是芳香烃
D.用分子筛固体催化剂工艺生产乙苯,可大幅度降低对环境的污染,同时提高经济效益
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com