
直接氧化法制备混凝剂聚合硫酸铁[Fe2(OH) n (SO4) 3-n/2]m (n>2 , m≤10)的实验流程如下:
 已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
已知:盐基度=n(OH-)/3n(Fe)×100% 。式中n(OH-)、n(Fe)分别表示PFS中OH-和Fe3+的物质的量。所得产品若要用于饮用水处理,需达到盐基度指标为 8.0%~16.0%。
(1)实验加入硫酸的作用是 。取样分析Fe2+浓度,其目的是 。
(2)用pH试纸测定溶液pH的操作方法为 。若溶液的pH偏小,将导致聚合硫酸铁中铁的质量分数 。(填“偏高”、“偏低”、“无影响”)
(3)氧化时控制反应温度为50~60℃的原因是 。
(4)聚合反应的原理为m[Fe2(OH)n(SO4) 3-n/2]
 [Fe2(OH)n(SO4)
3-n/2 ] m,则水解反应的化学方程式为 。
[Fe2(OH)n(SO4)
3-n/2 ] m,则水解反应的化学方程式为 。
(5)产品盐基度的测定方法:
Ⅰ 称取m g固体试样,置于400 mL聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。
Ⅱ 室温下放置10 min,再加入10 mL氟化钾溶液,摇匀,掩蔽Fe3+,形成白色沉淀。
Ⅲ 加入5滴酚酞指示剂,立即用物质的量浓度为c mol·L-1的氢氧化钠标准液滴定至终点,消耗体积为V ml。
Ⅳ 向聚乙烯烧杯中,加入25 mL盐酸标准溶液,再加20 mL煮沸后冷却的蒸馏水,摇匀,盖上表面皿。然后重复Ⅱ、Ⅲ做空白试验,消耗氢氧化钠标准液的体积为V0 ml。
①达到滴定终点的现象为 。
②已知试样中Fe3+的质量分数为w1,则该试样的盐基度(w)的计算表达式为 。
(16分)每空2分
(1)抑制Fe2+水解; 确定氧化Fe2+所需H2O2的量
(2)将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照; 偏低
(3)温度过低,反应太慢;温度过高, H2O2分解加快,导致氧化剂用量增加。
(4)Fe2(SO4)3+ nH2O
 Fe2(OH)n(SO4) 3-n/2
+ (n/2) H2SO4
Fe2(OH)n(SO4) 3-n/2
+ (n/2) H2SO4
(5)①加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色。
②w=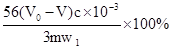
【解析】
试题分析:(1)Fe2+易水解,加入硫酸可以防止水解。取样分析Fe2+浓度,是定量分析,其目的是确定氧化Fe2+所需H2O2的量。
(2)pH试纸的操作方法是将小片pH试纸放在点滴板(或表面皿)上,用玻璃棒沾取少量待测液滴在试纸上,迅速与标准比色卡对照。若溶液的pH偏小,说明Fe2+有部分水解了,将导致聚合硫酸铁中铁的质量分数偏低。
(3)温度对化学反应速率有影响,另外H2O2会受热分解。故氧化时控制反应温度为50~60℃的原因是温度过低,反应太慢;温度过高, H2O2分解加快,导致氧化剂用量增加。
(4))水解的原理是Fe2+结合水中的OH-,方程式为Fe2(SO4)3+ nH2O
 Fe2(OH)n(SO4) 3-n/2
+ (n/2) H2SO4。
Fe2(OH)n(SO4) 3-n/2
+ (n/2) H2SO4。
(5)①酚酞与碱会变红,故达到滴定终点的现象为加入最后一滴NaOH标准液,烧杯中液体颜色恰好为浅红色,且30s内不变色。
②通过化学式的计算,w=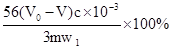 。
。
考点:盐类的水解 pH试纸的使用 方程式的书写 物质的量的相关计算
点评:本题是一道实验知识的题目,考查学生分析和解决问题的能力,综合性较强,难度大。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com