
 �����ʵ�����Ϊ3.00mol����A��B�����5L�� ���У��������·�Ӧ 3A+B?2C���ڷ�Ӧ������C�����ʵ����������¶ȱ仯��ͼ��ʾ��
�����ʵ�����Ϊ3.00mol����A��B�����5L�� ���У��������·�Ӧ 3A+B?2C���ڷ�Ӧ������C�����ʵ����������¶ȱ仯��ͼ��ʾ��| ��c |
| ��t |
| x |
| 3 |
| 2 |
| 3 |
| ||
(6-
|
| 1 |
| 3 |
| ||
| 2min |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ | SO42-��NO3-��Cl- |
| ������ | Fe3+��Fe2+��NH4+��Cu2+��Al3+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ�긣��ʡ�ĵ���У�߶��������¿���ѧ�Ծ����������� ���ͣ������
��14�֣���2L����ѹ�Ƶĺ����ܱ�������ͨ��2molX��g����1molY��g����������Ӧ��
2X��g��+Y��g�� 2Z��g������H��0���ﵽƽ��ʱ���������ʵ�����Ϊԭ����0.85������ش��������⡣
2Z��g������H��0���ﵽƽ��ʱ���������ʵ�����Ϊԭ����0.85������ش��������⡣
��1��ƽ��ʱZ�����ʵ���Ϊ___________������Ӧ����5min�ﵽƽ�⣬��Y��ƽ����Ӧ����Ϊ____________��
��2����ͬ�����½��з�Ӧ����t1ʱ�̣�ֻ�ı�����ijһ��������������ͼ����ͼ�ס�
A������ B������ C����ѹ D����ѹ E���Ӵ���
��c=0.90mol��t1ʱ�̸ı��������_________����ѡ���ţ���ͬ����t2_______5min (���������������=����ͬ����
��3���������������䣬ԭ����Ϊ��ѹ�������ﵽƽ���Z�����ʵ���______0.9mol (���������������=������
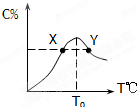
��4���������ʵ�����Ϊ3.00mol����X��Y�����5L�����з�����Ӧ���ڷ�Ӧ������Z�����ʵ����������¶ȱ仯��ͼ�ҡ�
��A��B����Z��������Ӧ���ʵĴ�С��ϵ��_________��
���¶�T��T0ʱ��Z%�������ԭ����______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2 L�����У��ֱ����ʵ�����Ϊ2.00 mol��SO2��O2��ϣ��ڲ�ͬ�¶ȣ�T��
�·������·�Ӧ��2SO2(g)+O2(g)�� ![]() �� 2SO3(g)����
�� 2SO3(g)����
�ڵ�10 sʱ�ֱ�ⶨ����SO3�����������SO3%��
�������ͼ��ʾ���ߣ�

��1���˷�Ӧ������ӦΪ������ �ȷ�Ӧ��
��2��A��B��������Ӧ���ʵĴ�С��ϵ�ǣ�vA���� vB
���������������O2��ʾT0��Ӧ��ƽ����Ӧ����![]() (O2)=������ ��������
(O2)=������ ��������
��3���¶�T��T0ʱ��SO3%�������ԭ��������������������������������������
�������������������������������������������������������������� ��
��4����B��SO3���������Ϊ40.0%����SO2��ת����Ϊ�������� ��
��5������B��Ļ�������5%ͨ�������BaCl2��Һ�����ɳ��������� g��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com