
水的电离平衡曲线如图所示,若以A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度,则下列说法正确的是
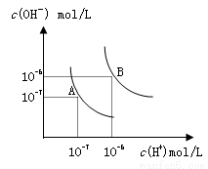
A.纯水中25℃时的c(H+)比100℃时的c(H+)大
B.100℃时某溶液中由水电离产生的c(H+)=1×10-11mol/L,则该溶液的pH可能是11或3
C.将pH=9的Ba(OH)2溶液与pH=4的稀盐酸混合,并保持100℃的恒温,混合溶液的pH=7,则Ba(OH)2溶液和盐酸的体积比为10: 1
D.25℃时,某Na2SO4 溶液中c(SO42-)=5×10-4 mol/L,则溶液中c(Na+):c(OH-)为104:1
D
【解析】
试题分析:A、水的电离为吸热反应,升高温度,水的电离程度增大,氢离子浓度增大,所以纯水中25°C时的c(H+)比100℃的时c(H+)小,错误;B、根据题给图像知,100℃时水的离子积为10-12,由水电离产生的c(H+)=1×10-11mol?L-1,若溶液为酸性溶液,氢离子浓度为:0.1mol/L,溶液的pH=1;若溶液为碱性溶液,则溶液中氢离子浓度为1×10-11mol?L-1,溶液pH=11,错误;C、100℃时水的离子积为10-12,混合溶液的pH=7,反应后的溶液为碱性溶液,溶液中氢离子浓度为1×10-7mol?L-1,氢氧根离子浓度为1×10-5mol?L-1; pH=9的Ba(OH)2溶液中氢氧根离子浓度为1×10-3mol?L-1,与pH=4的稀盐中氢离子浓度为1×10-4mol?L-1,设氢氧化钡的体积为x,盐酸溶液的晶体为y,则:(10?3x?10?4y)/(x+y) =1×10-5,解得x:y=1:10,错误;D、25℃时,氢离子浓度为1.0×10-7mol/L,钠离子浓度为1.0×10-3mol/L,则溶液中c(Na+):c(OH-)=1.0×10-3mol/L:1.0×10-7mol/L=104:1,正确。
考点:考查水的电离、溶液pH的计算。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学试卷(A卷)(解析版) 题型:选择题
下列反应的离子方程式正确的是( )
A.NaHCO3溶液中加入盐酸:CO32-+ 2H+ = CO2↑+ H2O
B.紫色石蕊试液中滴入氢硫酸变红的原因是:H2S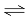 2H+ + S2-
2H+ + S2-
C.将NaHSO4溶液滴入Ba(OH)2溶液中至pH=7:2H+ + SO42-+ 2OH-+ Ba2+ = BaSO4↓+ 2H2O
D.电解CuSO4溶液:Cu2+ + 2H2O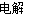 Cu + O2↑+ 4H+
Cu + O2↑+ 4H+
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高一上学期期末考试化学(A卷)试卷(解析版) 题型:选择题
仅用下表提供的玻璃仪器(非玻璃仪器任选)或实验装置(图1、图2)就能实现相应实验目的是
选项 | A | B | C | D |
实验项目 | 除去KCl中少 量MnO2 | 用10mol/L的盐酸配制100mL0.1mol/L的盐酸 | 用氯化钠溶液制备氯化钠晶体 | 除去CO2气体中的HCl |
实验仪器 或装置 | 烧杯、玻璃棒、分液漏斗 | 100mL容量瓶、玻璃棒、烧杯 |
图1 |
图2 |
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:填空题
(1)利用如图装置,可以模拟铁的电化学防护。若X为碳棒,为减缓铁的腐蚀,开关K应该置于 处。若X为锌,开关K置于M处,该电化学防护法称为 。

(2)肼(N2H4)又称联氨,是一种可燃性液体,其燃烧热较大且燃烧产物对环境无污染,故可以用作火箭燃料。肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。该电池放电时,通入肼的一极为 极,该极的电极反应式是 ,电池工作一段时间后,电解质溶液的pH将 (填“增大”、“减小”、“不变”)。
(3)碘被称为 “智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,可通过电解制备碘酸钾。(阴、阳两极均用惰性电极,阴极室与阳极室用阳离子交换膜隔开)请回答下列问题:电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。电解时,阳极上发生反应的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:填空题
已知某一种燃料含碳、氢和氧三种元素,为测定该燃料的组成:将该燃料放入到足量氧气中燃烧,并使产生的CO2与H2O蒸气以及剩余的O2全部通过如下图所示的装置,得到如下表所列出的实验数据(假设生成的气体是全部被吸收)。
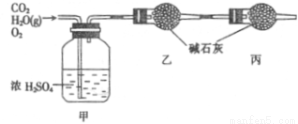
| 实验前 | 实验后 |
甲的质量 / g | 101.1 | 103.8 |
乙的质量 / g | 82.0 | 86.4 |
根据实验数据填空:
(1)该燃料分子中碳、氢原子的数目比为_______。
(2)已知该燃料分子的式量为46,且每个分子中含有1个氧原子,则其分子式为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的水溶液中不存在电解质分子
C.强电解质都是离子化合物,弱电解质都是共价化合物
D.不同的弱电解质只要物质的量浓度相同,电离程度也就相同
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二5月月考化学试卷(解析版) 题型:填空题
能和资是维系人类发展的重要前提之一。目前人类使用的主要能还是化石燃料。请回答下列问题:
(1)化石燃料包括煤、石油、 (写出另外一种化石燃料的名称)。煤炭开采过程中,若采取的措施不当,容易发生瓦斯爆炸事故,导致生命财产损失,用化学方程式解释在煤矿中频频发生瓦斯爆炸的原因:
。
(2)煤的气化可以缓解石油危机,而目前煤的气化主要是煤中的碳和水蒸气的反应:C+H2O(g)===CO+H2,该反应是一个吸热反应,反应所需的能量一般是由间歇进行的碳的燃烧(氧气用空气代替)提供的:C+O2===CO2。
①有人认为上述第一个反应需要吸热,所以煤的气化从能量角度看,得不偿失。请你解释这种观点的错误所在:
。
②煤的气化可以为工业合成氨提供原料气。氢气于 ,氮气于 ,还可以采用 工艺得到空气中的氮气。
(3)我国煤炭资相对石油和天然气资丰富,煤制油有一定的资保障。煤液化的重要方法是间接液化法,首先将煤气化为H2、CO和CH4,然后通过催化剂将气态物质转化为液态。通过间接法制备的燃油中含有饱和烷烃和不饱和烯烃,请完成下列粗煤气合成烯烃和烷烃的化学方程式:
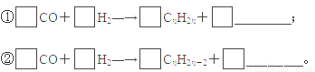
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高二5月月考化学试卷(解析版) 题型:选择题
随着社会的发展,人们日益重视环境问题,下列做法或说法不正确的是( )
A.绿色化学的核心是利用化学原理从头上减少和消除工农业生产等对环境的污染
B.将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水
C.大力实施矿物燃料“脱硫、脱硝技术”,减少硫和氮的氧化物对环境的污染
D.PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物
分散在空气中形成混合物具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省高一5月月考化学试卷(解析版) 题型:选择题
在一不可变容器中发生如下反应:2NO2  2NO + O2 ΔH ?0 达到平衡后,升温,混合气体的( )不变
2NO + O2 ΔH ?0 达到平衡后,升温,混合气体的( )不变
A. 密度 B.颜色 C.压强 D. 总物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com