
【题目】(1)实验室常用A的饱和溶液制备微粒直径为1nm-l00nm的红褐色液相分散系.则该反应的化学方程式为:________________,将A 的溶液加热蒸干并灼烧,得到固体的化学式为:_____________。
(2)B为地壳中含量最高的金属元素的氯化物,向50.0mL,6mol/L的B溶液中逐滴滴入100ml 某浓度的KOH溶液,若产生7.8g白色沉淀,则加入的KOH溶液的浓度可能为________________。
(3)将A、B中两种金属元素的单质用导线连接,插入一个盛有KOH溶液的烧杯中构成原电池,则负极发生的电极反应为:________________________。
(4)C、D、E均是短周期中同一周期元素形成的单质或化合物,常温下D为固体单质,C和E均为气态化合物,且可发生反应:C+D![]() E.则:
E.则:
①写出C 的电子式:________________。
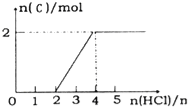
②将一定量的气体C通入某浓度的KOH溶液得溶液F,向F溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(C)的关系如图所示,则生成F 的离子方程式________________,F 中离子浓度由大到小的顺序为___________。
【答案】(1)FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl(2)3mol/L或11mol/L(2 分)
Fe(OH)3(胶体)+3HCl(2)3mol/L或11mol/L(2 分)
(3)Al- 3e-+4OH-=AlO2一+2H2O(2分)(4)①CO2的电子式![]() (2分)
(2分)
② CO2+2OH—=CO32—+H2O(2分)c(K+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)(3分)
【解析】试题分析:(1)由题意知该分散系为Fe(OH)3(胶体),Fe(OH)3(胶体)的制备方法:FeCl3+3H2O![]() Fe(OH)3(胶体)+3HCl 。如果将溶液加热蒸干HCl会挥发最后得到Fe(OH)3,将之灼烧产物为Fe2O3。
Fe(OH)3(胶体)+3HCl 。如果将溶液加热蒸干HCl会挥发最后得到Fe(OH)3,将之灼烧产物为Fe2O3。
(2)B为AlCl3,有0.3mol。①KOH不足,Al3++3OH-=Al(OH)3产生Al(OH)30.1mol,则KOH为0.3mol,故KOH浓度为3mol/L。②KOH过量,Al3+ + 3OH- = Al(OH)3 ,Al(OH)3 + OH- = AlO2- + H2O ,故KOH为1.1mol。故KOH浓度为11mol/L。
(3)负极是金属铝单质失电子变为Al3+,少量的Al3+与过量的OH-,继续反应生成AlO2-与H2O。故电极反应式为:Al-3e-+4OH-=AlO2一+2H2O。
(4)由题意知,该反应是CO2+C=2CO,故C为CO2,CO2是共价化合物,其电子式为![]() 。CO2气体通入KOH溶液会发生反应:CO2+2OH—=CO32—+H2O,F为K2CO3溶液,所以溶液中离子浓度由大到小的顺序是c(K+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)。
。CO2气体通入KOH溶液会发生反应:CO2+2OH—=CO32—+H2O,F为K2CO3溶液,所以溶液中离子浓度由大到小的顺序是c(K+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)。


 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如下装置制备氢化钙。

回答下列问题:
(1)检查装置E气密性的操作方法是 。
(2)利用上述装置制取氢化钙时按气流方向连接顺序为(填仪器接口的字母编号)。
i→_______→_______→_________→ → → →a
(3)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;______________(请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间 B.收集气体并检验其纯度
C.关闭分液漏斗活塞 D.停止加热,充分冷却
(4)写出CaH2与水反应的化学方程式__________________________ ;登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式,书写正确的是
A. KMnO4==K++Mn7++4O2- B. NaHCO3 = Na+ + H+ + CO32-
C. FeCl3==Fe3++Cl3- D. Al2(SO4)3==2Al3++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法不正确的是 ( )
A.并不是所有物质都含有化学键
B.只有非金属原子间才能形成共价键
C.单质不可能含有离子键
D.共价化合物中不可能含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方成式方程式正确的是( )
A.用纯碱溶液溶解苯酚:CO32-+C6H5OH→C6H5O-+HCO3-
B.用强碱溶液吸收工业制取硝酸尾气NO+NO2+2OH-=2NO3-+H2O
C.用二氧化锰和浓盐酸反应制氯气:MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D.向AlCl3溶液中滴加过量的氨水:Al3++4NH3·H2O=AlO2-+2H2O的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会产生副产物HCl。利用反应A,可实现氯的循环利用。
反应A:4HCl+O2![]() 2Cl2+2H2O
2Cl2+2H2O
已知:I.反应A中,4molHCl被氧化,放出115.6kJ热量。
II.
判断下列说法正确的是( )
A. 反应A的△H>-115.6kJ·mol-1
B. H2O中H—O键比HCl中H—Cl键弱
C. 由II中的数据判断氯元素的非金属性比氧元素强
D. 断开1molH—O键与断开1molH—Cl键所需能量相差31.9kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个反应:
①Fe+H2SO4(稀)===FeSO4+H2↑
②Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
试回答下列问题:
(1)反应①中________(填元素符号)被氧化,还原产物为________;反应②中________作还原剂,________元素被还原。
(2)当反应①生成2 g H2时,消耗H2SO4的质量是________ g。
(3)反应②中生成32 g SO2气体时,消耗H2SO4的质量是________ g,其中有________ g H2SO4被还原,转移电子________ mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素Y的核外电子数等于核内中子数,取2.8g该元素的单质与氧气充分反应,可得6.0g化合物YO2,则该元素在周期表中位置( )
A. 第三周期 B. 第一周期 C. 第ⅤA族 D. 第ⅥA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列氧化物中,加入水能进一步反应生成相应物质的是
A. SiO2→H2SiO3 B. SO3→H2SO4 C. NO→HNO3 D. Al2O3→Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com