
从淡化海水中提取溴的流程如图所示,下列有关说法错误的是( )

A.X为SO2气体,也可将SO2换成Na2SO3
B.设备Y为蒸馏塔
C.在提取溴的过程中一定有Br-被氧化
D.工业上每获得1molBr2,需要消耗Cl2的体积最多为22.4L(标准状态下)
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
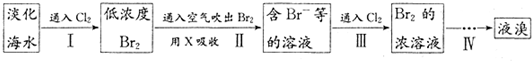
| A、X试剂可用Na2SO3饱和溶液 | B、步骤ID的离子反应:2Br-+Cl2═2Cl-+Br2 | C、工业上每获得1mol Br2,需要消耗Cl2 44.8L | D、步骤IV包含萃取、分液和蒸馏 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年四川省成都市高三第一次诊断性考试理综化学试卷(解析版) 题型:选择题
从淡化海水中提取溴的流程如下:

下列有关说法不正确的是
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br- + Cl2 = 2Cl- +Br2
C工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤IV包含萃取、分液和蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:单选题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com