
分析 (1)8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,Cu、O元素的化合价降低,Fe、S元素的化合价升高;
(2)A.只有二氧化硅不溶于稀盐酸;
B.滤液氧化常常选用H2O2,与亚铁离子发生氧化还原反应;
C.实验验证炉渣中含有FeO,可加酸溶解后,利用亚铁离子的还原性分析.
解答 解:(1)8CuFeS2+21O2$\frac{\underline{\;高温\;}}{\;}$8Cu+4FeO+2Fe2O3+16SO2中,Cu、O元素的化合价降低,Fe、S元素的化合价升高,
①含元素化合价降低的物质被还原,反应中被还原的元素是Cu、O,故答案为:Cu、O;
②由反应可知生成2mol Fe2O3时转移电子的物质的量为4mol×(3-2)+16mol×6=100mol,则生成1mol Fe2O3时转移电子的物质的量为50mol,故答案为:50;
(2)A.只有二氧化硅不溶于稀盐酸,则过滤的目的是除去SiO2,故答案为:除去SiO2;
B.滤液氧化常常选用H2O2,与亚铁离子发生氧化还原反应,离子反应为H2O2+2Fe2++2H+═2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+═2Fe3++2H2O;
C.实验验证炉渣中含有FeO,选择试剂为稀硫酸、KMnO4溶液,证明炉渣中含有FeO的实验现象为稀硫酸浸取炉渣所得的溶液使KMnO4溶液褪色,
故答案为:稀硫酸、KMnO4溶液;稀硫酸浸取炉渣所得的溶液使KMnO4溶液褪色.
点评 本题考查氧化还原反应和混合物分离提纯,为高频考点,注意把握元素化合价的判断,从化合价变化的角度分析,题目侧重于相关概念的考查,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳的结构式:O-C-O | B. | 羟基的电子式为: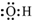 | ||
| C. | 丙烷分子的球棍模型: | D. | 硫离子的结构示意图: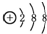 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核内有8个中子的碳原子${\;}_{8}^{14}$C | |
| B. | 基态氧原子核外电子的轨道表示式: | |
| C. | HClO的结构式为H-Cl-O | |
| D. | Ca2+的结构示意图为 ,NH4Cl的电子式为 ,NH4Cl的电子式为 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

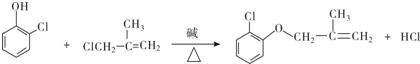 (有机物用结构简式表示,下同).
(有机物用结构简式表示,下同).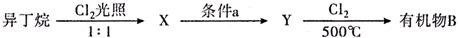
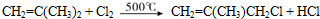 ;
;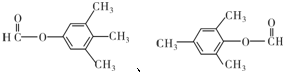
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{△}^{O_{2}}$CuO$\stackrel{稀H_{2}SO_{4}}{→}$CuSO4溶液$\stackrel{蒸发、结晶}{→}$CuSO4•5H2O | |
| B. | Fe$\stackrel{Cl_{2}}{→}$FeCl3$\stackrel{过量氨水}{→}$Fe(OH)3$\stackrel{灼烧}{→}$Fe2O3 | |
| C. | NaOH溶液$\stackrel{SO_{2}}{→}$Na2SO3$\stackrel{SO_{2}}{→}$NaHSO3$→_{灼烧}^{蒸干}$Na2SO4 | |
| D. | Al$→_{△}^{O_{2}}$Al2O3$\stackrel{HCl}{→}$AlCl3溶液$→_{△}^{蒸干}$AlCl3晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
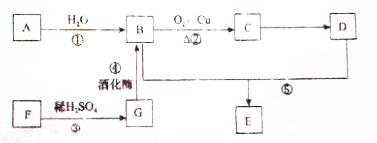
| A. | ①②⑤ | B. | ②④ | C. | ②③⑤ | D. | 只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合溶液的pH等于7 | B. | 混合溶液的pH大于7 | ||
| C. | 加入酸碱的物质的量相等 | D. | 混合溶液还能再中和盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com