
����Ŀ��������ѧ����ij�л����Ӻ�������״����C60�Ƴ��������׳���(��ͼ��ʾ�����������׳����ĶԽ��ߵij��Ƚ�Ϊ3��4����)��ÿ �������׳�������һ���л����Ӻ��ĸ�C60���ӹ��ɡ������׳��������������䵥�����л����ӡ�����˵������ȷ����

A.���������ۿ����������׳������˶�
B.�����׳����ĵ���˵��������ݷ��ӵļ���������һ���½�
C.C60��һ�����͵Ļ�����
D.C60��Ħ������Ϊ720gmol-1
���𰸡�C
��������
���ӡ�ԭ�ӡ������������ʡ�����ͨ���������۲죻һ��Ԫ����ɵĴ������ǵ��ʣ�����Ԫ����ɵĴ������ǻ����Ħ����������ֵ�������ԭ�������������е�λ![]() ��
��
A�������׳������˶��Ƿ��ӹ��ɵģ����ۿ����������ʣ���Ҫ�����߱������Ⱦ�ϸ�������й۲죬��A��ȷ��
B�����ǴӲ�֪�������ʣ����������ʣ��ƶ�ԭ�ӣ������׳������˶���ȷʵ��������ݷ��ӵļ������Ͻ�������B��ȷ��
C��C60ֻ��һ��Ԫ����ɣ������ǵ��ʣ����ǻ�������������⣬��C����
D��Ħ����������ֵ����Է���������ȣ�ͨ������õ�![]() ���������⣬��D��ȷ��
���������⣬��D��ȷ��
��ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������450mL 0.5mol/L������������Һ����ش��������⣺
(1)ȷ��ȡ�������Ƶ�����______��
(2)�����ƹ����У������õ���ʵ��������______(����ĸ)��
A.500mL����ƿB.������ƽC.Բ����ƿD.�ձ�E.������F.��ƿ
�����������⣬��ȱ�IJ���������______
(3)��������������Һʱ�����в������ܻ�ʹ������Һ���ʵ���Ũ��ƫ�͵���______
A������NaOH�����ѳ���
B������ƿ������������ˮ
C��ת����Һ������������Һ�彦��
D������ʱ���Ӷ���
E������ҡ�Ⱥ�Һ����ڿ̶��ߣ������μ�����ˮ���̶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����������һ���ƶ���������ʹ����������ѹ����ʼʱ����������2 mol SO2��1 mol O2������������4mol SO2��2 mol O2���ס��ҵ������Ϊ1L(��ͨ��������Բ���).������ͬ�¶����������ڵ������£�.�ر�����K��ʹ�����������Է���������Ӧ��2 SO2(g)+O2(g)![]() 2SO3(g)����ƽ��ʱ���������Ϊ0.8L������˵����ȷ����
2SO3(g)����ƽ��ʱ���������Ϊ0.8L������˵����ȷ����

A����������SO2��ת����С��60%
B��ƽ��ʱSO3������������ף���
C����K��һ��ʱ��.�ٴδﵽƽ��.�����Ϊ1.4 L
D��ƽ���������ٳ���2mol SO2��1mol O2��3moLSO3��ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F�� ���Ǻϳ�ij��ҩ����м��壬����һ�ֺϳ�·�����£�
���Ǻϳ�ij��ҩ����м��壬����һ�ֺϳ�·�����£�
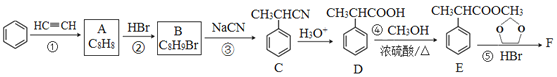
�ش��������⣺
��1��A�Ľṹ��ʽΪ______�������д���ͬһƽ���ԭ�������____����
��2��E�й�����������_____���١��������ڼӳɷ�Ӧ����_______������ţ���
��3����Ӧ�۵Ļ�ѧ����ʽΪ______________��
��4����Ӧ�ݵ������������֣�����F���⣬��һ���������������______��
��5������E�ĺϳ�·�ߣ����һ����![]() �ϳ�
�ϳ�![]() �ĺϳ�·��_________________�������Լ���ѡ��
�ĺϳ�·��_________________�������Լ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ��������ƽ���Ƶ�ˮ��Һ﮵����ϵ��������ʵ�ֵ綯�������10�뼴����ʻ400�����Ŀ�꣬��ṹ��ͼ��ʾ��������˵������ȷ����
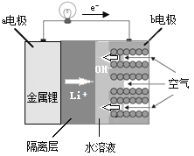
A.b�缫���ö�缫��Ŀ����������������
B.a�缫Ϊ��ص�����������﮷���������Ӧ
C.b�缫�ĵ缫��ӦΪO2+2H2O+4e-=4OH-
D.װ�����õ������㽫�缫���ˮ��Һ������Ŀ���Ƿ�ֹ�������ˮ������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ŷŵ���Ⱦ����Ҫ��̼�⻯���һ����̼�͵�������ȡ�
I������ȼ�ͳ��ϰ�װ��Ԫ��ת����������Ч��������β����Ⱦ��
��1����֪�� C(s)+O2(g) =CO2(g) ��H1 �� 393.5kJ��mol1
2C(s)+O2(g) =2CO(g) ��H2 �� 221.0 kJ��mol1
N2(g)+O2(g) =2NO(g) ��H 3 ��+180.5 kJ��mol1
CO��NO����β���ڴ�������������N2���Ȼ�ѧ����ʽ��_________________________��
��2���о�CO��NO�Ĵ���Ӧ�������崫���������ij�¶��¡�һ��������ܱ������У���ͬʱ��NO��COŨ�����±���
ʱ�䣨s�� | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/��104mol��L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/��103mol��L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
�� ǰ4 s�ڵ�ƽ����Ӧ������(CO) ��______mol��L1��s1��
�� L��X�ɷֱ����ѹǿ���¶ȡ���ͼA��ʾLһ��ʱ��NO(g)��ƽ��ת������X�ı仯��ϵ��X��������������______���ж�L1��L2�Ĵ�С��ϵ______�����������ɣ�______________________________��
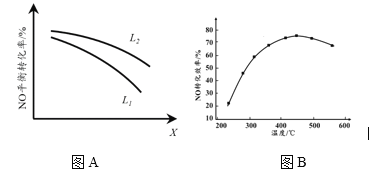
��3��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2) ��c2(CO2)��k����k��Ϊ���ʳ�����ֻ���¶��йأ���
�ٴﵽƽ��������¶ȣ�k������ı���______���>������<����=����k������ı�����
������2 L���ܱ������г���1 mol CO��1 mol NO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����k���Uk�� =___________��������һλС����
II. �������÷�ӦC(s)+2NO(g) ![]() N2(g)+CO2(g) ��H = 34.0 kJ��mol1���û���̿��NO���������������ܱ������м���������C��һ������NO���岢�ڴ��������·�����Ӧ������ͬʱ����NO��ת�������¶ȵı仯��ͼB��ʾ����ͼ��֪���ת���ʶ�Ӧ�¶�Ϊ450��������450��ʱ��NO��ת����______����ǡ����ߡ����ǡ�����Ӧ�¶��µ�ƽ��ת���ʣ��ж�������________________________������450OCʱ��NO��ת���ʽ��͵Ŀ���ԭ����___________�����ţ�
N2(g)+CO2(g) ��H = 34.0 kJ��mol1���û���̿��NO���������������ܱ������м���������C��һ������NO���岢�ڴ��������·�����Ӧ������ͬʱ����NO��ת�������¶ȵı仯��ͼB��ʾ����ͼ��֪���ת���ʶ�Ӧ�¶�Ϊ450��������450��ʱ��NO��ת����______����ǡ����ߡ����ǡ�����Ӧ�¶��µ�ƽ��ת���ʣ��ж�������________________________������450OCʱ��NO��ת���ʽ��͵Ŀ���ԭ����___________�����ţ�
A���������Խ��� B��ƽ�ⳣ����С C�� ��Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ҽҩ��ʯ����ҵ���й㷺��;����ͼ��ģ�ҵ�Ʊ��������Ʒ���������̣�
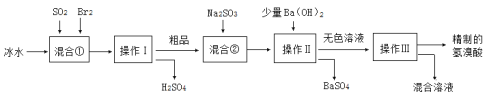
����˵������ȷ����
A.��ˮ��Ŀ���ǽ��ͷ�Ӧ�¶ȣ���ֹ��ӷ���ʹ��Ӧ�����
B.��Ϣٷ����ķ�ӦΪ��SO2 +2H2O + Br2=H2SO4 + 2HBr
C.������Ͳ���������Ʒֱ�Ϊ���˺�����
D.Na2SO3�������ǵ�����Һ��pHҲ������Na2CO3���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����C��s�����ʯ�� + O2��g��=CO2��g�� ��H1=��395.4 kJmol-1���� C��s��ʯī�� + O2��g��=CO2��g�� ��H2=��393.5 kJmol-1 ������Ӧ�е������仯��ͼ��ʾ������˵����ȷ����
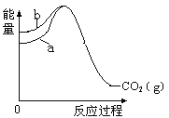
A.ʯī�ͽ��ʯ֮���ת���������仯
B.ͼ�� b ������Ӧ�ٵ������仯
C.C��s�����ʯ�� =C��s��ʯī�� ��H= +1.9 kJmol-1
D.���ʯ��ʯī�����ȶ��Ժ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijУ��ѧ����С��Ϊ�˼���̼���ƺ�̼���������ְ�ɫ���壬�ò�ͬ�ķ�����������ʵ�飬��ͼ����ʾ��
��. ��.
��.  ��.
��. 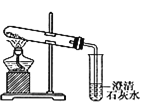 ��.
��. 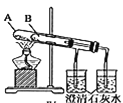
(1)ֻ����ͼ����ʾʵ�飬�ܹ��ﵽʵ��Ŀ����(��װ�����)___________��
(2)ͼ����ʾʵ����ܼ������������ʣ������ʱ���ܷ����ķ�Ӧ�Ļ�ѧ����ʽΪ_________.
(3)��ͬѧ��Ϊ�����������鷽���⣬�����ֹ�����ɵ���Һ�м������ʯ��ˮҲ�����������ǣ�����˵����________(������ȷ������������)��.������NaHCO3��Һ�м�����������ʯ��ˮ��������Ӧ�����ӷ���ʽΪ��______
(4)������ƿ��Һ����֪�ֱ���K2CO3��Һ��NaHCO3��Һ������д������_________
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com