
关于A(g)+2B(g)═3C(g)的化学反应,下列表示的反应速率最大的是( )
A.v(A) = 0.6mol/(L•min) B.v(B) = 1.2mol/(L•min)
C.v(C) = 1.2mol/(L•min) D.v(B) = 0.03mol/(L•s)
科目:高中化学 来源:2016-2017学年湖南省高二上开学测化学试卷(解析版) 题型:选择题
下列各化合物中,阳离子与阴离子半径之比最小的是( )
A. LiI B. LiF C. NaCl D. KBr
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期摸底考试化学试卷(解析版) 题型:选择题
对实验I~IV的实验现象预测正确的是

A.实验I:液体分层,上层呈紫红色
B.实验II:烧杯中先出现白色沉淀,后溶解
C.实验III:试管中溶液颜色变为血红色
D.实验IV:放置一段时间后,饱和CuSO4溶液中出现白色晶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
用NA表示阿伏伽德罗常数的数值,下列说法正确的是( ).
A.标准状况下,11.2L H2O所含的水分子数目为0.5NA
B.16g O2和O3的混合气体中所含的氧原子数目为NA
C.1.00mol/L Na2CO3溶液中所含Na+的数目为2NA
D.0.1mol Zn与含0.1mol HCl的盐酸充分反应,产生H2数目为0.2NA
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期摸底化学试卷(解析版) 题型:选择题
假设某化学反应的反应过程如下图所示观察分析,符合图中变化的化学反应为
A.A 2 +3B 2  2AB 3
2AB 3
B.2AB 2 +B 2  2AB 3
2AB 3
C.2A 2 B+5B 2 ==4AB 3
D.2AB 2 +B 2 ==2 AB 3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省汕头市高二上学期入学考试化学试卷(解析版) 题型:实验题
工业上常用铁质容器盛装冷浓硫酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动。
【探究一】
(1)甲同学将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移入硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是____________________。
【探究二】
(2)另称取铁钉6.0 g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。乙同学取336 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O===2HBr+H2SO4然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为________。
分析上述实验中SO2体积分数的结果,丙同学认为气体Y中还可能含有H2和Q气体。为此设计了下列探究实验装置(图中夹持仪器省略):

(3)装置B中试剂的作用是________。
(4)认为气体Y中还含有Q的理由是_____________________(用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于________(选填序号)。
a.A之前 b.A—B间 c.B—C间 d.C—D间
(6)如果气体Y中含有H2,预计实验现象应是_________________。
查看答案和解析>>
科目:高中化学 来源:2017届新疆生产建设兵团二中高三上第一次月考化学试卷(解析版) 题型:填空题
金属材料在日常生产生活中有着广泛的应用,请回答下列问题:
(1)人类最早使用的合金是___________,目前使用量最大的金属是________。
(2)铁和铁合金是日常生活中的常用材料,下列叙述正确的是________。
A.纯铁的硬度比生铁高
B.纯铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素
D.铁在一定条件下,可与水蒸气反应
E.铁在冷的浓硫酸中会钝化
(3)向沸水中滴入几滴饱和FeCl3溶液,加热至液体呈透明的红褐色,该反应的离子方程式为__________,形成的分散系中分散质的微粒直径范围是_________。
(4)向硫酸亚铁溶液中加入过氧化钠,有红褐色沉淀生成,如果加入的Na2O2与生成的O2的物质的量之比为3:1,请写出发生的离子反应方程式___________________。
(5)电子工业需要用30%的FeCl3溶液腐蚀绝缘板上的铜,制造印刷电路板。请写出FeCl 3 溶液与铜反应的离子方程式:_________________,向腐蚀后的废液中加入一定量的铁粉充分反应后,无固体剩余,则反应后的溶液中一定含有的离子是___________,可能含有的离子是_________。如果从腐蚀后的废液中回收铜并重新获得FeCl3溶液,现有下列试剂:①氯气②铁粉③浓硝酸④浓盐酸⑤烧碱⑥浓氨水。需要用到的一组试剂是_______。
A.①②④ B.①③④⑥ C.②④⑤ D.①④⑥
(6)高铁酸钠(Na2FeO4)是一种新型净水剂。高铁酸钠的制备方法之一是:在碱性条件下用NaClO氧化Fe3+,请写出该反应的离子反应方程式______________。
(7)有一种铁的氧化物样品,用5mol/L盐酸140mL,恰好完全溶解,所得溶液还能吸收标况下0.56L氯气,恰好使其中Fe2+全部转化成Fe3+,该氧化物的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上第一次周练化学试卷(解析版) 题型:实验题
锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β?锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
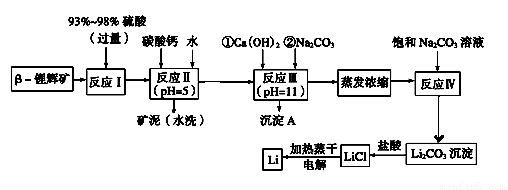
已知:
①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
请回答下列问题:
(1)用氧化物形式表示LiA lSi2O6的组成:_______________________
lSi2O6的组成:_______________________
(2)反应Ⅱ加入碳酸钙的作用是____________________
(3)写出反应Ⅲ中生成沉淀A的离子方程式:____________________
(4)洗涤所得Li2CO3沉淀要使用“热水”还是“冷水”理由是____________________
(5)流程中两次使用了Na2CO3溶液,第一次浓度小,第二次浓度大的原因是____________________
(6)该工艺中,电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com