
| A. | 钢铁发生电化学腐蚀时,负极反应为Fe-3e-=Fe3+ | |
| B. | 镀锡铁制品和镀锌铁制品的镀层破损时,镀锡铁制品中铁的腐蚀速率更快 | |
| C. | 在轮船船体四周镶嵌锌块保护船体不受腐蚀的方法叫阳极电化学保护法 | |
| D. | 不锈钢有较强的抗腐蚀能力是因为在钢铁表面镀上了铬 |
分析 A、钢铁发生电化学腐蚀时,负极反应为Fe-2e-=Fe2+;
B、镀锡铁制品与镀锌铁制品都可以组成原电池;
C、在轮船船体四周镶嵌锌块保护船体不被腐蚀的方法是形成了原电池;
D、不锈钢是在钢中加入铬、镍等金属,改变内部结构.
解答 解:A、钢铁发生电化学腐蚀时,负极反应为Fe-2e-=Fe2+,而生不成铁离子,故A错误;
B、镀锡铁制品与镀锌铁制品都可以组成原电池,由于铁的活泼性强于锡,镀锡铁制品中铁为负极,加快自身腐蚀,而镀锌铁制品中铁为正极得到保护,故B正确;
C、在轮船船体四周镶嵌锌块保护船体不被腐蚀的方法是形成了原电池,船体做原电池的正极,方法叫牺牲阳极的阴极保护法,故C错误;
D、不锈钢是在钢中加入铬、镍等金属,改变内部结构,并不是在金属表面覆盖保护层,故D错误;
故选B.
点评 本题考查金属的电化学腐蚀和防护等,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
| KMnO4酸性溶液 的浓度/mol•L-1 | 溶液褪色所需时间 t/min | ||
| 第1次 | 第2次 | 第3次 | |
| 0.01 | 14 | 13 | 12 |
| 0.001 | 6 | 7 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| T | T的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 |
| X | X的原子内层电子数是其最外层电子数的三分之一 |
| Y | 在第三周期元素中,Y的简单离子半径最小 |
| Z | T、X、Z组成的36电子的化合物A是家用消毒剂的主要成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相对分子质量相同,组成元素也相同的化合物一定是同分异构体 | |
| B. | 凡是分子组成相差一个或若干个CH2原子团的物质,彼此一定是同系物 | |
| C. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定是同分异构体 | |
| D. | 分子式相同的不同有机物一定互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉碘化钾在空气中变蓝:2I-+O2+4H+═2H2O+I2 | |
| B. | Fe2O3溶于足量的氢碘酸溶液中:Fe2O3+6H+=2Fe3++3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+Ca2+=CaCO3↓ | |
| D. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2=2CO2+2CaSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Cl-、Fe2+、Ba2+ | B. | OH-、NO3-、Ba2+、Cl- | ||
| C. | H+、CO32-、Mg2+、Ba2+ | D. | OH-、NO3-、CO32-、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
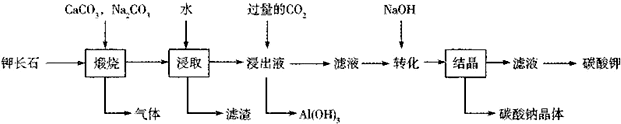
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com