
| A. | B>C>A>D | B. | A>C>D>B | C. | D>A>C>B | D. | C>D>A>B |
分析 ①物质的量浓度相同的A、C溶液中,分别滴入甲基橙试液后,A溶液呈黄色而C中不变色,说明A溶液的pH大于4.4,C溶液的pH介于3.1~4.4,则酸性C>A;
②物质的量浓度相同的钠盐溶液,酸根离子水解程度越大,钠盐溶液pH越大,则酸的酸性越弱,物质的量浓度相同的B、C的钠盐溶液相比较,B的钠盐溶液的pH小于C的钠盐溶液的pH,则C为一元弱酸,酸性B>C;
③酸A和D的钠盐反应生成A的钠盐和酸D,根据强酸能和弱酸盐反应生成弱酸知,酸性A>D,
据此判断四种酸的酸性强弱.
解答 解:由①知A溶液的pH大于4.4,C溶液的pH介于3.1~4.4,说明C的酸性比A的酸性强;
由②知B的酸性比C的酸性强,因酸越弱,其钠盐水解的程度越大,所得溶液的pH越大,所以酸性B>C;
由“较强酸+较弱酸的盐反应能生成较强酸的盐+较弱的酸”的规律可知,A的酸性比D的酸性强,所以酸性酸性A>D,
即酸性强弱顺序为:B>C>A>D,
故选A.
点评 本题以弱电解质电离为载体考查酸性强弱判断,明确酸的电离程度与酸根离子水解程度关系、强酸制取弱酸原理即可解答,熟练掌握弱电解质电离特点,题目难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 25℃时、用醋酸溶液滴定等浓度NaOH溶液至pH=7,V醋酸>VNaOH | |
| C. | 在蒸馏水中滴加浓H2SO4,KW不变 | |
| D. | NaCl 溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
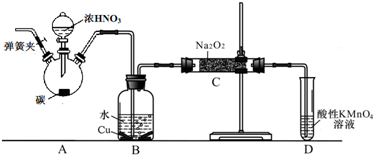
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3的质量分数将增加 | B. | 平衡向正反应方向移动 | ||
| C. | 平衡向逆反应方向移动 | D. | 正逆反应速率都增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
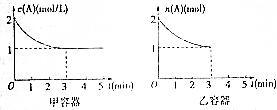
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
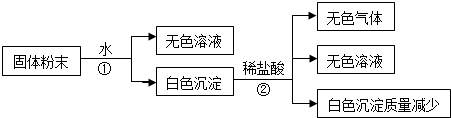
| 序号 | 化 学 式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2是氧化剂,NaOH是还原剂 | |
| B. | 被氧化的Cl原子和被还原的Cl原子的物质的量的比为5:1 | |
| C. | 每生成1mol的NaClO3转移6mol的电子 | |
| D. | Cl2既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com