
| A. | 生成 SO3 为2mol | |
| B. | 单位时间消耗amol O2,同时消耗2amol SO2 | |
| C. | SO2 和 SO3物质的量之和一定为 2mol | |
| D. | SO2和SO3的浓度一定相等 |
分析 A.可逆反应的特点:反应不能进行到底.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物;
B.单位时间消耗amol O2,同时消耗2amol SO2都是指正反应方向;
C.根据元素守恒进行判断;
D.SO2的物质的量和SO3物质的量的大小关系取决于原始投料量和转化率.
解答 解:A.可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物,故生成SO3小于2mol,故A错误;
B.单位时间消耗amol O2,同时消耗2amol SO2都是指正反应方向,故B错误;
C.根据S元素守恒可知,S的总的物质的量保持不变,即SO2和SO3物质的量之和一定为2mol,故C正确;
D.SO2的物质的量和SO3物质的量的大小关系取决于原始投料量和转化率,故D错误,
故选C.
点评 本题考查可逆反应的特点,难度不大,要注意可逆反应无论进行多长时间,反应物都不可能100%地全部转化为生成物.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取一定量酸性高锰酸钾溶液和过量草酸(H2C2O4)溶液混合,分成三等份,分别置于不同的温度下,观察比较溶液颜色变化的快慢以探究温度对反应速率的影响 | |
| B. | 可用酒精萃取溴水,将分液漏斗振摇几次后需要从分液漏斗上口放气 | |
| C. | 标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 | |
| D. | 用镊子夹取金属钠固体,切割取用后剩余的钠不能放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | KMnO4 | C. | 浓HCl | D. | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
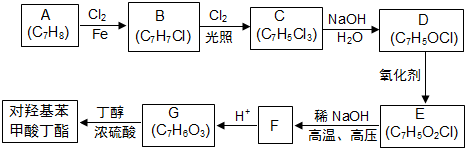
 ; F的分子式为C7H4O3Na2;
; F的分子式为C7H4O3Na2; ,该反应类型为取代反应;
,该反应类型为取代反应;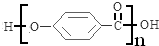 .
.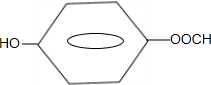 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2gO3和2 gO2 | B. | 9克H2O和0.5NA个CO2 | ||
| C. | 标准状况下1molO2和22.4LH2O | D. | 0.2molH2和4.48LHCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com