
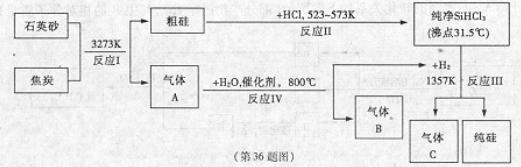
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:不详 题型:填空题

 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;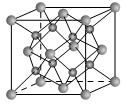
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/kJ·mol—1 | 360 | 436 | 431 | 176 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
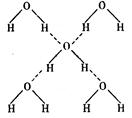
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
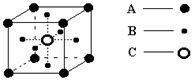
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
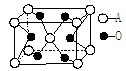
| A.一定是共价化合物 | B.可能是离子化合物 |
| C.它的化学式为AO2 | D.它的化学式为A3O2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4 "
为5. 71g·cm-3,晶胞边长为4.28×10-10m(Ni的相对原子质量为58.7,O的相对原子质量为16)。求:(已知:4.283="78.4 " 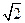 =1.4)
=1.4)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
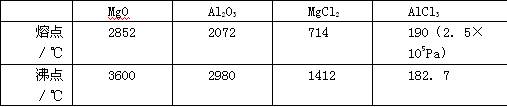

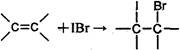
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.胶体溶液的电泳现象说明胶体带电荷 |
| B.含有非极性键的化合物一定为共价化合物 |
| C.原子晶体中共价键越强其熔点越高,如晶体硅比Si02熔点高 |
| D.含有阴离子的物质必然含有阳离子.但含有阳离子的物质不一定含有阴离子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com