
COCl2(g) CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
CO(g)+Cl2(g) ΔH>0。当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是( )
A.①②④ B.①④⑥
C.②③⑤ D.③⑤⑥
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
安徽省“十二五”规划指出:“加强生态文明建设,发展循环经济,推广低碳技术,推动绿色增长”。下列做法有悖于生态文明建设的是 ( )
A.禁止使用化学合成的农药,促进绿色食品和有机食品的生产
B.应用高效洁净的能源转换技术,提高能源的利用效率
C.加快化石燃料的开采与使用,满足经济快速发展需要
D.在火电厂推广碳收集和储存技术
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3的反应
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源: 题型:
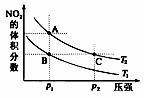
反应N2O4(g) 2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.由状态B到状态A,可以用加热的方法
D.A、C两点气体的平均相对分子质量:A>C
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下在某定容容器中发生反应:2A(g) +3B(g) ===2C(g),开始时,A的浓度为2 mol·L -1,B的浓度是4 mol·L-1 ,2 min后,A的浓度减少0.8 mol·L-1 ,则
(1)v(B) =___________,v(C) =____________。
(2)在2min末,C的浓度是____________,B的浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化钠(Na3N)是科学家制备的一种重要化合物,它与水作用可产生NaOH和NH3。请回答下列问题:(1)Na3N的电子式是__________;该化合物是由__________键形成的__________(填“离子”或“共价”)化合物。
(2)Na3N与盐酸反应生成__________种盐,对应的反应方程式是 。
(3)比较Na3N中两种微粒的半径:r(Na+)__________r(N3-)(填“>”“=”“<”符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com