
| A. | 酒精的燃烧热△H=(Q2-Q3-3Q1)kJ/mol | |
| B. | 由③可知1molC2H5OH(g)的能量大于2molCO2(g)和3molH2O(g)的总能量 | |
| C. | H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液态酒精完全燃烧生成CO2(g)和H2O(l),放出的热量为(0.5Q2-0.5Q3-1.5Q1)kJ |
分析 A、反应热是指生成液态水时放出的热量;
B、焓变是指反应物的能量和与生成物的能量和之差,不是一部分;
C、放热反应是指化学反应;
D、据盖斯定律解答.
解答 解:A、③生成的是水蒸气,不是液态水,所以根据盖斯定律,酒精的燃烧热△H=△H=(-Q2-Q3-3Q1)kJ/mol,故A错误;
B、△H=生成物的能量和-反应物的能量和,B中少了氧气,故B错误;
C、H2O(g)→H2O(l)是物理变化,故C错误;
D、已知:①H2O(g)═H2O(l)△H=-Q1 kJ•mol-1
②C2H5OH(g)═C2H5OH(l)△H=-Q2 kJ•mol-1
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3 kJ•mol-1
据盖斯定律:③-②+①×3得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-Q3+Q2-3Q1)KJ/mol,23g是0.5molC2H5OH,所以释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ,故D正确;
故选D.
点评 本题考查燃烧热、焓变、放热反应以及盖斯定律的应用,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
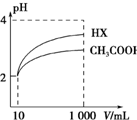 弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:
弱酸HA的电离常数Ka=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | HNO2 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 5.1×10-4 | 1.8×10-5 | 6.2×10-10 | K1=4.4×10-7 K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
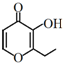 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SiO3.H2S CO2 | B. | H2O NH3•H2O HClO. | ||
| C. | H2SO3.Ba(OH)2BaSO4 | D. | Cu(OH)2CH3COOH CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
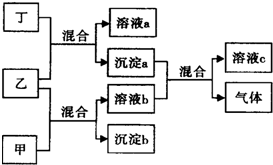 现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):
现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al | B. | Al(OH)3 | C. | Al3+ | D. | [Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com