
�ϳɰ�����Ҫ�Ļ�ѧ��ҵ��Ϊ���о��ϳɰ��ķ�Ӧԭ������һ�ܱ������ڳ���1 mol N2��2 mol H2����һ�������£�ʹ֮�������·�Ӧ��N2+3H2  2NH3��
2NH3��
����ά���¶Ȳ��䣬���ܱ��������ݻ��̶�Ϊ1 L��
L��
(1) ���˷�Ӧ����2 min�ﵽƽ��״̬ʱ����÷�Ӧ�������NH3�����ʵ���Ϊ0.2 moL����H2��2 min�ڵ�ƽ����Ӧ����Ϊ__________________��
(2)�����ʼʱ����������ڼ���0.5 moL N2��Ҫʹ��Ӧ�������������������ʵ���������������ƽ��ʱ����ȫ��ͬ���������H2 _______mo l��NH3 _______mol��
l��NH3 _______mol��
(3)�����ʼʱ����N2��H2��NH3�����ʵ����ֱ�Ϊa mol ��b mol ��c mol ��Ҫʹ��Ӧ�ﵽƽ��״̬ʱ����Ӧ�������������������ʵ�����������(1)ƽ��ʱ��ȫ��ͬ����a��b��cӦ�����һ�������ǣ�a��b�ֱ��ú�c�ķ���ʽ��ʾ�� ��
�����¶�ά�ֲ��䣬��ϵѹǿά�������ͬ���ܱ��������ݻ���1 L�淴Ӧ���ж��ı䡣
(4)��ʼʱ����1 mol N2��2 mol H2������һ��ʱ�䣬������������������ʵ����������ٷ����仯ʱ����NH3�����ʵ���Ϊ__________��ѡ��һ����ţ�
(��)����0.2 mol (��)����0.2 mol
(��)С��0.2 mol (��)���ܴ��ڡ����ڻ�С��0.2mol
�������жϵ�������__________________________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2012-2013ѧ��ӱ���ǿ��ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ����������� ���ͣ������
��֪���з�Ӧ����Ӧ������������������ʵĻ�ѧ������������ȥ����
��A+B  M+D+E����E��M=A+F+B
M+D+E����E��M=A+F+B
��ش�
��1����A��һ�����Σ��÷�Ӧ�ǻ�ѧ��ҵ���Ƶ���E�ͻ�����M����Ҫ�������û�ѧ��ҵ��Ϊ ������ĸ��ţ�a�����Ṥ ҵ b���ȼҵ c���ϳɰ���ҵd�������Ƽҵ����д��������Ӧ�ڵ����ӷ���ʽΪ__________ ��
��2����A��һ�ֺ������Σ��÷�Ӧ�е缫�ϻ�������ɫ���塣�����ⷴӦ����ʽ�ǣ� ���������ֲ�ͬ��Ӧ�еIJ���E����1���⣩�Ͳ���F����2���⣩��һ�ֹ�ͬ����;��__ ____, ���߷�Ӧ�����ӷ���ʽΪ______________ __��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��ӱ�ʡ���и߶���ѧ������������⻯ѧ�Ծ��������棩 ���ͣ������
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯�����ڹ� ũҵ������������������Ҫ���ã�
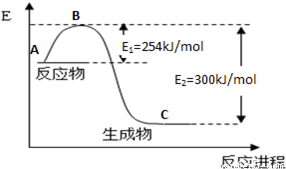
��1����ͼ��N2(g)��H2(g)��Ӧ����1mol NH3(g)�����������仯ʾ��ͼ����д��N2��H2��Ӧ���Ȼ�ѧ����ʽ�� ��
��2������֪�������ݣ�
|
��ѧ�� |
H��H |
N��N |
|
����/kJ��mol��1 |
435 |
943 |
�Ը��ݱ��м�ͼ�����ݼ���N-H�ļ��� kJ��mol��1��
��3���ϳɰ���Ӧͨ��������ý��������ʹ������ý��E1��E2�ı仯�ǣ�E1 ��E2______��
��H (���������С���������䡱)��
��4����NH3����ԭNOX���������������������Ⱦ������
4NH3(g)+3O2(g)�� 2N2(g)+6H2O(g) ����H1��akJ��mol-1
N2(g)+O2(g)��2NO(g)�� ��H2��bkJ/mol
��1mol NH3��ԭNO��N2����÷�Ӧ�����еķ�Ӧ�ȡ�H3�� kJ/mol���ú�a��b��ʽ�ӱ�ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014��ӱ���ǿ��ѧ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
��֪���з�Ӧ����Ӧ������������������ʵĻ�ѧ������������ȥ����
��A+B  M+D+E����E��M=A+F+B
M+D+E����E��M=A+F+B

��ش�
��1����A��һ�����Σ��÷�Ӧ�ǻ�ѧ��ҵ���Ƶ���E�ͻ�����M����Ҫ�������û�ѧ��ҵ��Ϊ ������ĸ��ţ�a�����Ṥ ҵ b���ȼҵ c���ϳɰ���ҵd�������Ƽҵ����д��������Ӧ�ڵ����ӷ���ʽΪ__________ ��
��2����A��һ�ֺ������Σ��÷�Ӧ�е缫�ϻ�������ɫ���塣�����ⷴӦ����ʽ�ǣ� ���������ֲ�ͬ��Ӧ�еIJ���E����1���⣩�Ͳ���F����2���⣩��һ�ֹ�ͬ����;��__ ____, ���߷�Ӧ�����ӷ���ʽΪ______________ __��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���Ĵ�ʡģ���� ���ͣ������
 2NH3(g)����H= -92.4 kJ/mol��
2NH3(g)����H= -92.4 kJ/mol��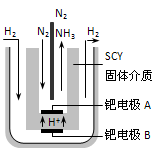
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ģ���� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com