
【题目】下列说法正确的是( )
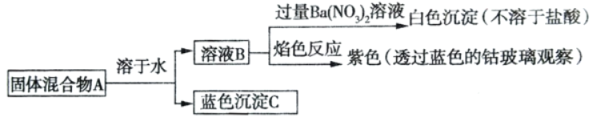
A.固体混合物 A 是 CuSO4 和 NaOH
B.固体混合物 A 是 CuSO4 和 KOH
C.固体混合物 A 是 CuCl2 和 KOH
D.固体混合物 A 是 CuSO4 和 Ba(OH)2
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为__。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为__。
(3)![]() 的沸点比
的沸点比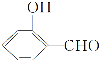 高,原因是___。
高,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:酸式乙二酸钠与浓硫酸共热时反应为![]() 。利用该反应所产生的气体(X)用有关仪器装置进行实验:
。利用该反应所产生的气体(X)用有关仪器装置进行实验:
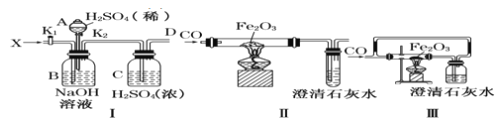
下列说法不正确的是( )
A.对I装置,活塞![]() 关闭,打开活塞
关闭,打开活塞![]() ,在导管D处能得到纯净而干燥的CO
,在导管D处能得到纯净而干燥的CO
B.当A选项反应完成后,再关闭活塞![]() ,打开活塞
,打开活塞![]() ,在导管D处得到纯净而干燥的
,在导管D处得到纯净而干燥的![]()
C.利用装置I中D处所得纯净CO气体,通过实验装置II能够说明CO具有还原性
D.实验装置III与实验装置II相比较,能减少CO污染,能顺利完成氧化铁还原实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从宏观和微观两个角度认识氯、硫、铁、铝等元素的单质及其化合物是学好中学化学的重要基础。完成下列填空:
(1)Cl在元素周期表中的位置为______________,由此可知,其最高价氧化物对应的水化物的化学式 为:______________ ,次氯酸分子的结构式为:_____________。
(2)Cl、S、Na三种元素形成简单离子其半径由大到小的顺序是_______________________(用离子符号 表示)。铝最高价氧化物对应的水化物表现出了独特的性质,其在水溶液中的电离方程式 为____________________________________________________________________________。
(3)硫和氯的非金属性强弱关系是_________________,试从原子结构的角度解释其原因。______________
(4)现有试剂:溴水、硫化钠溶液、Na2SO3溶液、稀硫酸、NaOH溶液、氨水。要证明Na2SO3具有还原 性,应选用的试剂有______________,看到的现象是 ____________________。要证明Na2SO3具有氧化性,应选用的试剂有___________________,反应的离子方程式是 ________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2H2(g)+O2(g)=2H2O(l)△H=﹣483.6 kJmol﹣1,则氢气的燃烧热为483.6 kJmol﹣1
B. 在一定温度和压强下,将0.5mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放出热量19.3 kJ,则其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) △H=﹣19.3kJ/mol
2NH3(g) △H=﹣19.3kJ/mol
C. 已知2C(s)+2O2(g)=2CO2(g)△H1 2C(s)+O2(g)=2CO(g)△H2 则△H1>△H2
D. 已知Ni(CO)4(s)=Ni(s)+4CO(g) △H=Q kJmol﹣1,则Ni(s)+4CO(g)=Ni(CO)4(s) △H=﹣Q kJmol﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.对于可逆反应CO+H2O(g)![]() CO2+H2,回答下列问题:
CO2+H2,回答下列问题:
(1)830 K时,若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为 _____________;平衡常数K的值为 _____________。
(2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为_____________ 。
(3)若830 K时,某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol·L-1c(CO)=0.6 mol·L-1c(H2O)=3 mol·L-1,c(H2)=2 mol·L-1请判定该体系中反应进行的方向:______________ (填“正向进行”“逆向进行”或“达到平衡”)。
Ⅱ恒温恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1mol A和1mol B,达到平衡后,生成a mol C,这时A的物质的量为 _______ mol。
(2)若开始时放入3mol A和3mol B,达到平衡后,生成C的物质的量为 _______mol。
(3)若开始时放入x mol A2mol B和1mol C,达到平衡后,A和C的物质的量分别为y mol和3a mol,则x= ______,y= _________。
(4)若在(3)的平衡混合物中再加入3mol C,待再次达到平衡后,C的物质的量分数是 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨氧化法是工业生产中制取硝酸的主要途径,某同学用该原理在实验室探究硝酸的制备和性质,设计了如下图所示的装置:
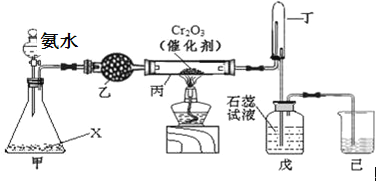
(1)若分液漏斗中氨水的浓度为9.0molL﹣1,配制该浓度的氨水100mL,用到的玻璃仪器有100mL容量瓶、烧杯、玻璃棒、 。
(2)甲装置不需要加热即能同时产生氨气和氧气,烧瓶内固体X的名称为 。
(3)乙装置的作用是 ;写出受热时丙装置发生反应的化学方程式为 。
(4)当戊中观察到 现象,则说明已制得硝酸。某同学按上图组装仪器并检验气密性后进行实验,没有观察到此现象,请分析实验失败的可能原因 。如何改进置 。
(5)改进后待反应结束,将丁装置倒立在盛水的水槽中,会观察到的现象是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下0.1molL﹣1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
A. 将溶液稀释到原体积的2倍B. 加入适量的醋酸钠固体
C. 加入等体积0.2 molL﹣1盐酸D. 加少量冰醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com