
A.HCO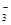 >HSO3- >HSO3- | B.CO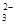 >SO >SO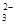 | C.HCO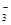 >ClO- >ClO- | D.ClO->SO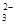 |
 考前必练系列答案
考前必练系列答案科目:高中化学 来源:不详 题型:单选题
| A.升高温度,正反应速率减小,逆反应速率增加,平衡逆向移动 |
| B.升高温度,可提高CO2转化率 |
| C.增加H2的浓度,可提高CO2转化率 |
| D.改用高效催化剂,可增大反应的平衡常数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子 |
| B.强电解质的水溶液导电性强于弱电解质的水溶液 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.强电解质易溶于水,弱电解质难溶于水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.稀释pH=10的氨水,溶液中所有离子的浓度均降低 |
| B.常温下物质的量浓度相等的①(NH4)2CO3、②NH4A1(SO4)2、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>①>② |
| C.pH=ll的NaOH和pH=ll的氨水分别稀释100倍后的pH前者一定大于后者 |
| D.分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,0.1 mol·L-1 CH3COOH溶液的pH=1 |
| B.铅蓄电池在放电过程中,负极质量增加,正极pH减少 |
| C.反应CO2(g)+C(s)=2CO(g)在低温下不能自发进行,则其△H>0 |
| D.常温下,向AgCl浊液中加入少量NaCl饱和溶液,则c(Ag+)、Ksp(AgCl)均减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下物质的量浓度相等的①(NH4)2CO3 ②(NH4)2SO4③ (NH4)2Fe(SO4)2三种溶液中水的电离程度:③>②>① |
B.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)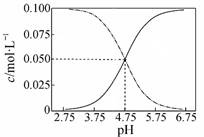 |
| C.向Ca(OH)2溶液中加入过量的NaHCO3溶液: Ca2++2HCO3-+2OH-→ CO32-+CaCO3↓+2H2O |
| D.25°C时,HCN溶液的电离平衡常数(Ka)与NaCN溶液的水解平衡常数(K)存在如下关系: Kw ·K = Ka |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A. |
| B.加入少量CH3COONa固体后,c(CH3COO—)降低 |
| C.该溶液中由水电离出的c(H+)是1.0×10-11 mol/L |
| D.与等体积pH =11的NaOH溶液混合后所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.混合后溶液中存在有关系:C(K+)+C(Na+)+C(H+)=C(SO32-)+C(HSO3-)+C(OH-) |
| B.混合后溶液中存在有关系:C(K+)+C(H2SO3)+C(H+)=C(SO32-)+C(OH-) |
| C.混合后溶液中存在有关系:C(SO32-)+C(HSO3-)+C(H2SO3)=0.02 mol/L |
| D.两溶液混合前,Na2SO3溶液中,水电离出C(H+)小于KHSO3溶液中水电离出C(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com