
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl?、S2-
B.使酚酞变红的溶液中可能大量存在Na+、ClO?、SO42-、I?
C.碱性溶液中可能大量存在Na+、K+、HCO3?、CO32-
D.中性溶液中可能大量存在Fe3+、K+、SCN-、SO42-
科目:高中化学 来源:2015-2016学年辽宁东北育才学校高二下第二段考化学试卷(解析版) 题型:实验题
高分子材料E和含扑热息痛高分子药物的合成流程如下图所示:
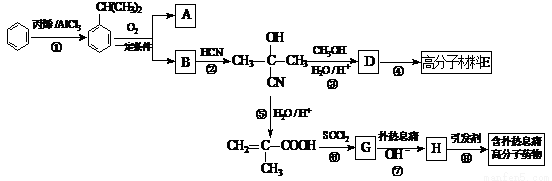
已知:I.含扑热息痛高分子药物的结构为: 。
。
II.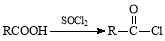
试回答下列问题:
(1) ①的反应类型为____________,G的分子式为____________
①的反应类型为____________,G的分子式为____________
(2)若1 mol 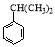 可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式______________
可转化为1 mol A和1 mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式______________
(3)反应②为加成反应,扑热息痛的结构简式为
(4)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32% 。D分子中所含官能团为______________
(5)写出含扑热息痛高分子药物与足量氢氧化钠溶液发生反应的化学方程式_____ 。
(6)D有多种同分异构体,其中与D具有相同官能团,且能发生银镜反应的同分异构体有_______种(考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三考前高考模拟十化学试卷(解析版) 题型:填空题
碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol·L -1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重复测定2次,所得的相关数据如下表:
测定 序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:填空题
有一混合物水溶液,含有以下离子中的若干种:Na+、NH4+、Cl—、Ba2+、HCO3—、SO42—,现各取100mL溶液分别进行如下实验:
①第一份加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL
③第三份加足量Ba(OH)2溶液,得沉淀4.30g,再用足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,回答以下问题:
(1)由第一份进行的实验推断该混合物是否一定含有Cl-:____________;(填“是”或“否”)
(2)由第二份进行的实验可知混合物中应含有____________离子,其物质的量浓度为____________;
(3)由第三份进行的实验可知4.30g沉淀的成份为____________,写出生成该沉淀的离子方程式:____________;
(4)溶液中肯定存在的离子是____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:选择题
对于常温下0.1mol/L氨水和0.1mol/L醋酸,下列说法正确的是
A.0.1mol/L氨水,溶液的pH=13
B.0.1mol/L氨水加水稀释,溶液中c(H+)和c(OH-)都减小
C.0.1mol/L醋酸溶液中:c(H+)=c(CH3COO-)
D.0.1mol/L醋酸与0.1mol/LNaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:选择题
目前,世界上已经合成了几百种有机超导体,下图所示是其中之一,该分子结构如下图所示.下列关于该化合物说法错误的是( )

A.分子中所有的氮原子在同一平面内
B.属于芳香烃
C.分子式为C12H4N4
D.该物质易溶于水
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:填空题
仔细分析如图装置,完成下面的填空:
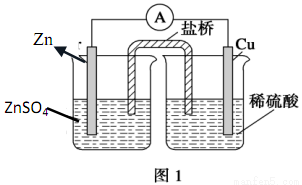
(1)该反应的电流方向是_____________。
(2)盐桥中的阴离子向________溶液中移动。
(3)一段时间后,锌片上的现象是_____________,铜片上的现象是______________。
(4)锌极发生_________反应,总反应方程式为_________________。
(5)30min后,1.3g的Zn参加了反应,则转移了_______个电子。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:填空题
根据碳、钙、铜等元素的单质及其化合物的结构和性质,请回答下列问题:
(1)实验室用CaC2与水反应生成乙炔:
①①将乙炔通入[Cu(NH3)2]Cl溶液中反应生成红棕色Cu2C2沉淀,Cu+基态核外电子排布式为__________。其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu20,试从结构角度解释高温下CuO何会生成Cu2O:__________。
②CaC2中C22-与O22+互为等电子体,0.5molO22+中含有的π键数目为__________;
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是__________,构成丙烯腈的元素中第一电离能最大的是__________。
(2)①铜元素的醋酸盐晶体局部结构如图甲,该晶体中含有的化学键是__________(填选项序号)
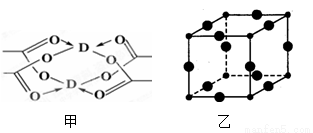
A.极性键 B.非极性键 C.配位键 D.金属键
②Cu3N的晶胞结构如图乙,N3-的配位数为__________ ,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为__________ g•cm-3.(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:选择题
如图所示的实验,能达到实验目的是( )
A | B | C | D |
|
|
|
|
验证化学能转化为电能 | 验证温度对平衡移动的影响 | 验证铁发生氢腐蚀 | 验证非金属Cl>C>Si |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com