
【题目】下列图与对应的叙述相符的是![]()
A.由图甲可知:![]() 的燃烧热为
的燃烧热为![]()
B.由图乙可知:![]() 时刻改变的条件是增大压强或者升高温度
时刻改变的条件是增大压强或者升高温度
C.由图丙可知:将上述HX、HY、HZ溶液等体积混合,用NaOH溶液滴定至HX恰好完全反应时,溶液中的离子浓度:![]()
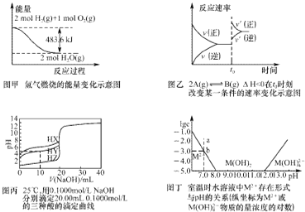
D.由图丁可知:室温时![]() 的溶度积常数为
的溶度积常数为![]()
科目:高中化学 来源: 题型:
【题目】下列实验合理的是( )
|
|
|
|
A.证明非金属性Cl>C>Si | B.制备少量氧气 | C.除去Cl2中的HCl | D.吸收氨气,并防止倒吸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
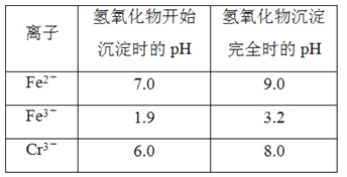
【题目】欲降低废水中重金属元素铬的毒性,可将Cr2O![]() 转化为Cr(OH)3沉淀除去。已知该条件下:
转化为Cr(OH)3沉淀除去。已知该条件下:
(1)某含铬废水处理的主要流程如图所示:
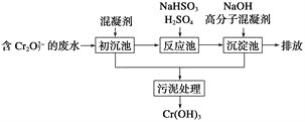
①初沉池中加入的混凝剂是K2SO4·Al2(SO4)3·2H2O,其作用为(用离子方程式表示)____。
②反应池中发生主要反应的离子方程式是Cr2O72-+3HSO3-+5H+===2Cr3++3SO42-+4H2O。根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是_____、____。证明Cr3+沉淀完全的方法是____。
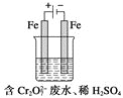
(2)工业可用电解法来处理含Cr2O![]() 废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
废水。实验室利用如图装置模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是_____,得到的金属阳离子在阴极区可沉淀完全。用电解法处理该溶液中0.01molCr2O72-时,至少得到沉淀的质量是____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图1表示0.2mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
B. 图2表示用0.1000mo1· L—1NaOH溶液滴定25.00mLCH3COOH的滴定曲线,则c(CH3COOH)=0.100 mo1· L—1
C. 图3表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH
D. 图4表示恒温恒容条件下,2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,二元弱酸H2R的pKa1=1.85,pKa2=7.45(已知pKa=-lgKa)。在此温度下向20mL0.1molL-1H2R溶液中滴加0.1molL-1的NaOH溶液,溶液的pH随NaOH溶液体积的变化如图所示。

下列有关说法正确的是( )
A. a点所示溶液中:c(H2R)+c(HR-)+c(R2-)=0.1molL-1
B. b点所示溶液中:c(Na+)>c(HR-)>c(H2R)>c(R2-)
C. c点溶液中水电离程度大于d点溶液
D. d点所示溶液中:c(Na+)>c(R2-)>c(HR-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常情况下,NCl3是一种油状液体,其分子空间构型与NH3相似。下列对NCl3和NH3的有关叙述正确的是( )
A.NCl3的沸点高于NH3的沸点
B.在氨水中,大部分NH3与H2O以氢键(用“…”表示)结合形成NH3H2O分子,则NH3H2O的结构式为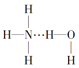
C.NCl3分子是非极性分子
D.NBr3比NCl3易挥发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,FeS的Ksp=6.3×10-18,CuS的Ksp=1.3×10-36,ZnS的Ksp=1.3×10-24。下列有关说法中正确的是
A. 饱和CuS溶液中Cu2+的浓度为1.3×10-36 mol·L-1
B. 25℃时,FeS的溶解度大于CuS的溶解度
C. 向物质的量浓度相同的FeCl2、ZnCl2的混合液中加入少量Na2S,只有FeS沉淀生成
D. 向饱和ZnS溶液中加入少量ZnCl2固体,ZnS的Ksp变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,用浓度为
时,用浓度为![]() 的NaOH溶液滴定
的NaOH溶液滴定![]() 浓度均为
浓度均为![]() 的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是
的三种酸HX、HY、HZ,滴定曲线如图所示.下列说法正确的是![]()

A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:![]()
B.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
C.用NaOH溶液滴定HY,当![]() 时溶液中
时溶液中![]()
D.当三种酸均滴定至![]() 时,HZ所用NaOH溶液体积最小
时,HZ所用NaOH溶液体积最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
已知:N2H4·H2O高温易分解,易氧化
制备原理:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl
(实验一) 制备NaClO溶液(实验装置如图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外,还有_____(填标号)
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2)锥形瓶中发生反应化学程式是_____________________________。
(实验二) 制取水合肼。(实验装置如图所示)
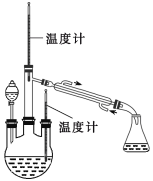
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108-114馏分。
(3)分液漏斗中的溶液是____________(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO混合溶液
选择的理由是____________。蒸馏时需要减压,原因是______________。
(实验三) 测定馏分中肼含量。
(4)水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体(保证滴定过程中溶液的pH保持在6.5左右),配制1000mL溶液。
b.移取10.00 mL于锥形瓶中,加入10mL水,摇匀。
c.用0.2000mol/L碘溶液滴定至溶液出现______________,记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(5)滴定时,碘的标准溶液盛放在______________滴定管中(选填:“酸式”或“碱式”)水合肼与碘溶液反应的化学方程式________________________。
(6)若本次滴定消耗碘的标准溶液为8.20mL,馏分中水合肼(N2H4·H2O)的质量分数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com