
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中一定有乙炔 | D. | 混合气体中一定没有乙烷 |
分析 混合气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,完全燃烧得0.16molCO2和3.6g水,水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,由原子守恒可知烃的平均组成,以此来解答.
解答 解:混合气体的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,完全燃烧得0.16molCO2和3.6g水,水的物质的量为$\frac{3.6g}{18g/mol}$=0.2mol,
由原子守恒可知,烃中C为$\frac{0.16mol}{0.1mol}$=1.6,H为$\frac{0.2mol×2}{0.1mol}$=4,平均组成为C1.6H4,
只有甲烷中C原子数小于1.6,则一定含甲烷,由H原子数为4,可知另一种烃为乙烯或丙炔,一定不存在乙烷,
故选AD.
点评 本题考查有机物分子式计算的确定,为高频考点,把握烃的燃烧规律、原子守恒为解答的关键,侧重分析与计算能力的考查,注意守恒法的应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
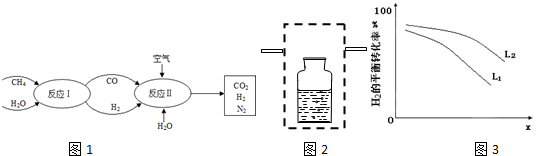
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;NH3的稳定性比PH3的强(填“强”或“弱”).
;NH3的稳定性比PH3的强(填“强”或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
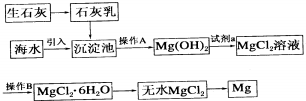
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

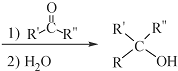
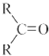 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$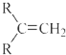 (R表示烃基,R′和R″表示烃基或氢)
(R表示烃基,R′和R″表示烃基或氢)  .写出A中含氧官能团的名称:羟基
.写出A中含氧官能团的名称:羟基 或
或 .(不考虑环状结构)
.(不考虑环状结构) .
.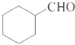 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL 1mol/L的NaCl溶液 | B. | 150 mL 1mol/L的MgCl2溶液 | ||
| C. | 100mL 1mol/L的HCl溶液 | D. | 50mL 1mol/L的AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
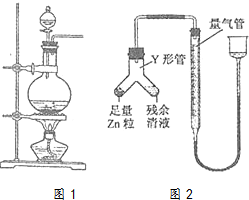 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com