
【题目】如图表示工业SO2催化氧化反应过程中的速率(v)与时间(t)的关系曲线,下列叙述正确的是( )

A. t2-t3,气体总物质的量保持不变(已知该条件下SO3为气体)
B. t2时,v(SO2)正和v(O2)逆相等且等于0
C. t1时刻,只有正方向的反应没有逆方向的反应
D. t2-t3,处于静止状态,反应不再发生
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】欲除去甲烷气体中混有的乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的装置.
A.澄清石灰水、浓H2SO4
B.酸性KMnO4溶液、浓H2SO4
C.溴水、浓H2SO4
D.CCl4、碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用萃取法从碘水中分离碘,所用萃取剂应具有的性质是( ) ①不和碘或水起化学反应 ②能溶于水 ③不溶于水 ④应是极性溶剂 ⑤应是非极性溶剂.
A.①②⑤
B.②③④
C.①③⑤
D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.所有的电子在同一区域里运动
B.能量高的电子在离核近的区域运动,能量低的电子在离核远的区域运动
C.处于最低能量的原子叫基态原子
D.同一原子中,1s、2s、3s所能容纳的电子数越来越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________。
(2)步骤2 中所发生反应的离子方程式为_________________。
(3)步骤3 中加入过量KI的作用是_________________。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的用途错误的是
A. 水玻璃可用作木材防火剂
B. 二氧化硅是制造光导纤维的材料
C. 石英是制造太阳能电池的常用材料
D. 石灰石和纯碱均是生产普通玻璃的原料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空:
(1)反应3A(g)+B(g)═2C(g)在三种不同的条件下进行反应,在同一时间内,测得的反应速率用不同的物质表示为①vA=1 mol/(Lmin)、②vC=0.5mol/(Lmin)、③vB=0.5mol/(Lmin),三种情况下该反应速率由大到小的关系是 . (用序号表示)
(2)某温度时,在一个5L的恒容容器中,X、Y、Z均为气体,三种物质的物质的量随时间的变化曲线如图所示.根据图中数据填空: 
①该反应的化学方程式为 .
②反应开始至2min,以气体Z表示的平均反应速率为 .
③2min反应达平衡容器内混合气体的平均相对分子质量比起始时(填“大”,“小”或“相等”下同),混合气体密度比起始时 .
④上述反应,在第2min时,X的转化率为 .
⑤将a mol X与b mol Y的混合气体发生上述反应,反应到某时刻各物质的量恰好满足:n (X)=n (Y)=n (Z),则原混合气体中a:b= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____周期,第_____族,其基态原子的核外电子排布式是________。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________个σ键,________个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________,其中X与Cu2+之间以_____________键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________。
b._________________________________。
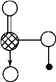
(6) 如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________,若晶胞边长为a cm,则晶体的密度为_______________(用含a、NA的代数式表示)(g/mL)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将100mL1Lmol-1的NaHCO3溶液分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO32-)的变化分别是( )
A.减小、减小B.增大、减小C.增大、增大D.减小、增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com