
(1)判断混合气体是否能完全燃烧。
(2)总体积减少100 mL后,所得气体是什么?有多少毫升?
(3)共生成CO2多少毫升?最后剩余125 mL气体是什么?
(4)原混合气体中各有多少毫升?
解析:(1)采用极限法,判断O2是否过量。根据CH4+2O2;2H2+O2;2CO+O2可知即使75 mL气体都为CH4气体,O2都过剩,因而75 mL混合气体可完全燃烧。
(2)燃烧并干燥的气体是CO2和剩余的O2,体积为200 mL+75 mL-100 mL=175 mL。
(4)设原混合气体中含CH4、H2、CO体积各为x、y、z,则
CH4+2O2=CO2+2H2O
x 2x
2H2+O2=2H2O
y ![]()
2CO+O2=2CO2
z ![]()
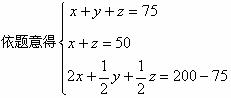
解之得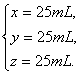
答案:(1)完全燃烧。(2)CO2和O2;175 mL。(3)CO2,50 mL;O2。(4)CH4,25 mL;H2,25 mL;CO,25 mL。


科目:高中化学 来源: 题型:
(1)判断混合气体是否能完全燃烧。
(2)总体积减少100 mL后,所得气体是什么?有多少毫升?
(3)共生成CO2多少毫升?最后剩余125 mL气体是什么?
(4)原混合气体中各有多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)丁烷在一定条件下加热可裂解产生CH4和C3H6,也可生成C2H4和C2H6。当丁烷进行裂解时,若有75%的丁烷发生裂解生成CH4、C3H6、C2H4、C2H6,此时混合气体的相对平均分子质量为____________。(取整数)
(2)常温下将50 mL的盐酸和150 mL的NaOH溶液混合并摇匀,测得混合后溶液的pH=12(混合后溶液的体积为200 mL)。如果混合前盐酸与NaOH溶液的物质的量浓度相等,则混合前它们的物质的量浓度是____________。
(3)一定条件下,反应N2+3H2![]() 2NH3在2 L的定容密闭容器中进行,5 min内氨的质量增加1.7 g,则在这段时间内用H2的减少来表示反应的平均速率应为_____________mol·(L·min)-1。
2NH3在2 L的定容密闭容器中进行,5 min内氨的质量增加1.7 g,则在这段时间内用H2的减少来表示反应的平均速率应为_____________mol·(L·min)-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,甲烷的燃烧热是多少?
(2)现有CO和CH4组成的混合气体共0.75 mol,完全燃烧生成二氧化碳气体和18 g液态水,放出热量为?多少??
(3)120 ℃、101 kPa下,a mL由CO和CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。①若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为____________(保留2位小数)。
②若燃烧后气体体积缩小了a/4 mL,则a与b关系的数学表示式是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com