
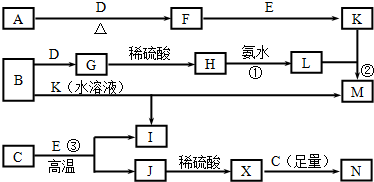
分析 F是淡黄色固体,且且是因氧化物,其焰色反应为黄色,则F为Na2O2,金属A与气体D反应生成F,则A为Na、D为O2,氧化物E在常温下是无色液体,与过氧化钠反应生成K,则B是H2O、K是NaOH.金属B与氧气反应生成氧化物G,G能与硫酸反应生成H,H与氨水反应得到白色胶状沉淀L,则B为Al、G为Al2O3、H为Al2(SO4)3、L为Al(OH)3、M为NaAlO2、无色气体I为H2.金属C与E在高温下生成氢气与J,J与硫酸反应生成X为硫酸盐,而X能与C反应得到N,说明金属C为变价金属,则C为Fe,Fe3O4,X为FeSO4和Fe2(SO4)3的混合溶液,N为FeSO4,据此解答.
解答 解:F是淡黄色固体,且且是因氧化物,其焰色反应为黄色,则F为Na2O2,金属A与气体D反应生成F,则A为Na、D为O2,氧化物E在常温下是无色液体,与过氧化钠反应生成K,则B是H2O、K是NaOH.金属B与氧气反应生成氧化物G,G能与硫酸反应生成H,H与氨水反应得到白色胶状沉淀L,则B为Al、G为Al2O3、H为Al2(SO4)3、L为Al(OH)3、M为NaAlO2、无色气体I为H2.金属C与E在高温下生成氢气与J,J与硫酸反应生成X为硫酸盐,而X能与C反应得到N,说明金属C为变价金属,则C为Fe,Fe3O4,X为FeSO4和Fe2(SO4)3的混合溶液,N为FeSO4.
(1)F为Na2O2,F的一种重要用途:用于呼吸面具或潜水艇中作为氧气的来源,
故答案为:用于呼吸面具或潜水艇中作为氧气的来源;
(2)反应③的化学方程式是:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(3)反应①的离子方程式是:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(4)反应②的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(5)为检验N中含有的Fe2+,取少量N的溶液,向其中加入KSCN溶液,振荡后,再加入 氯水(或H2O2)后,溶液立即呈血红色,
故答案为:氯水(或H2O2)后;血红色.
点评 本题考查无机物的推断,题目难度中等,注意根据物质的颜色、反应的现象、特殊反应等为突破口进行推断,学习中注意元素化合物的性质,注重相关知识的积累.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:解答题
| 组分 | CO | CO2 | H2 |
| 体积分数 | 20% | 5% | 75% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验操作 | 实验现象与结论 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 制备溴苯的实验装置如图所示,回答下列问题:
制备溴苯的实验装置如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | MgCl2 | C. | BF3 | D. | PCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | F | |
| 电离能/kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的相对原子质量逐渐增大 | B. | 核外电子排布呈现周期性变化 | ||
| C. | 原子半径呈现周期性变化 | D. | 元素化合价呈现周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com