
常温下,下列各组离子可能大量共存的是
A.水电离的H+浓度c(H+)=10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
B.使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
C.加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
D.中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016-2017学年湖南长沙市新高一分班考试化学(解析版) 题型:选择题
不使用其它试剂,区分①CuSO4 ②NaOH ③NaCl ④HCl的可能先后顺序是( )
A. ①③②④ B. ①②③④ C. ④①③② D. ②①③④
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上第一次月考(开学考试)化学(解析版) 题型:选择题
如图是MgSO4、NaCl的溶解度曲线。下列说法正确的是( )

A.MgSO4的溶解度随温度升高而升高
B.NaCl的溶解度比MgSO4的溶解度大
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三7月暑期阶段性测试化学试卷(解析版) 题型:选择题
取一定质量的均匀固体混合物Cu、Cu2O和CuO,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少6.40g ,另一份中加入500ml稀硝酸,固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为
A.3.2mol/L B.3.6mol/L C.4.0mol/L D.无法判断
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三7月暑期阶段性测试化学试卷(解析版) 题型:选择题
根据侯氏制碱原理制备少量NaHCO3的实验,经过制取氨气、制取NaHCO3、分离NaHCO3、干燥NaHCO3四个步骤,下列图示装置和原理能达到实验目的的是
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三入学考试理综化学试卷(解析版) 题型:填空题
【化学-选修3:物质结构与性质】(15分)
铁、铜及其化合物在日常生产、生活有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_______(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______;Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
Fe(s)+xCO(g)。已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型为_________。
(3)写出CO的一种常见等电子体分子的结构式_______;两者相比较沸点较高的为_____(填化学式)。CN-中碳原子杂化轨道类型为_______,C、N、O三元素的第一电离能最大的为____(用元素符号表示)。
(4)铜晶体中铜原子的堆积方式如图1所示。
①基态铜原子的核外电子排布式为___________。
②每个铜原子周围距离最近的铜原子数目________。
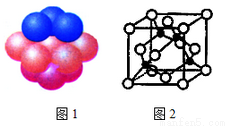
(5)M原子的价电子排布式为3s23p5,铜与M形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于______(填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为___________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三入学考试理综化学试卷(解析版) 题型:选择题
一种三室微生物燃料电池污水净化系统原理如右图所示,图中有机废水中有机物可用C6H10O5表示。有关说法错误的是
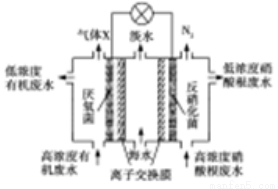
A.中间室Cl-移向左室
B.反应后将左右两室溶液混合比反应前将两室溶液混合的酸性强
C.气体X为CO2
D.左边离子交换膜为氯离子交换膜,右边离子交换膜为钠离子交换膜
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省大连市高二下期末化学试卷(解析版) 题型:实验题
现有一份含有FeCl3和FeCl2固体的混合物,为测定FeCl2的含量,进行如下实验:
①称取混合物样品的质量7.06g,将样品溶解
②向溶解后的溶液中,加入足量的双氧水
③再向②所得溶液中加入足量的NaOH溶液,得到红褐色沉淀
④将沉淀过滤、洗涤后,加热灼烧,到质量不再减少,得到固体物质4.00g
根据实验回答下列问题:
(1)样品溶解过程中需加入 ,以防止 ;
(2)写出溶解后的溶液与双氧水反应的离子方程式 ;
(3)过滤操作中除用漏斗外,还需要的玻璃仪器有 ;
(4)简述检验实验步骤④中沉淀已经洗涤干净的方法 ;
(5)通过实验所得数据,计算固体样品中FeCl2的质量分数: ;
(6)实验室采用如图装置制取少量无水FeCl3固体.(已知FeCl3固体易潮解,部分夹持仪器已略去.)

该装置存在明显缺陷,得不到无水FeCl3固体,请你对该装置进行合理的改进: .
查看答案和解析>>
科目:高中化学 来源:2017届河北沧州市高三上学期第一次月考化学试卷(解析版) 题型:选择题
制备(NH4)2Fe(SO4)2·6H2O的实验中,需对过滤出产品的母液(pH<1)进行处理。常温下,分别取母液并向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.通入过量Cl2:Fe2+、H+、NH4+、Cl-、SO42-
B.加入少量NaClO溶液:NH4+、Fe2+、H+、SO42-、ClO-
C.加入过量NaOH溶液:Na+、Fe2+、NH4+、SO42-、OH-
D.加入过量NaClO和NaOH的混合溶液:Na+、SO42-、Cl-、ClO-、OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com