���������������Ϣ��H��һ�ּ������������л�ԭ�Ե�����������ѧ�ж�ΪSO
2��D��X���Ӷ���10�������ܺͶ�������Ӧ�������ֶ�����Ԫ����ɵ�����A��˵��DX�м��Ե�10���������жϺ���NH
3������D��XΪˮ�Ͱ��������AΪ����������泥�ת��ͼ��X�������Ʒ�Ӧ��ȷ��XΪˮ��DΪ����������X+Na
2O
2��Y+B��D
E
F��H+Y��I�������ж�YΪ������BΪ�������ƣ�����ת����ϵ������ʵ����ʷ����ж�A+B��C+X+D�������ķ�ӦΪ����NH
4��
2SO
3+NaOH��NH
3+H
2O+Na
2SO
3���ƶ�CΪNa
2SO
3��XΪH
2O��DΪSO
2������ת����ϵ���������������ж����ʷ���������ݻ�ѧƽ�������ʽ��ʽ�����й�����
����⣺����H��һ�ּ������������л�ԭ�Ե�������ͨ������������ʺͻ��ϼۿ�֪�������������м��̬����������Ҳ���Խ��ͣ���ѧ�������ж�HΪ��������D��X���Ӷ���10���������ҺͶ�������Ӧ��������Ԫ����ɵ����Σ�˵��DX���кͶ�������Ӧ�ļ������壬�ƶ�DX���а�������ת����ϵX+Na
2O
2��Y+B����֪XΪH
2O���������ݷ�ӦD+H+X��A��A�������ֶ�����Ԫ����ɵ�����Ϊ��NH
4��
2SO
3������ת����ϵX+Na
2O
2��Y+B��D
E
F��H+Y��I�������ж�YΪ������BΪNaOH�����ת��ͼ�еĹ�ϵA+B��C+X+D�������ķ�ӦΪ����NH
4��
2SO
3+NaOH��NH
3+H
2O+Na
2SO
3���ƶ�CΪNa
2SO
3��C+K��H ��SO
2����˵��KΪ�ᣬH+Y��I �����ķ�ӦΪSO
2+O
2��SO
3�� I+X��K�����ķ�ӦΪSO
3+H
2O=H
2SO
4���ƶ�IΪ��������KΪ����ۺϷ���ת����ϵ��D
E
F
G���������ķ�ӦΪ��NH
3NO
NO
2HNO
3��
��������ת����ϵ�и������ж�Ϊ��A����NH
4��
2SO
3�� B��NaOH�� C��Na
2SO
3�� D��NH
3�� E��NO�� F��NO
2�� G��HNO
3�� H��SO
2�� I��SO
3�� K��H
2SO
4�� X��H
2O�� Y��O
2��
��1��ͨ�����������ƶ�AΪ����NH
4��
2SO
3��DΪNH
3�������ĽṹʽΪ��
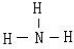
�ʴ�Ϊ������NH
4��
2SO
3 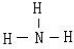
��2������ת����ϵ�����ڸ��ֽⷴӦ��ת��Ϊ��A+B��C+D+X��C+K��H����ѧ����ʽΪ����NH
4��
2SO
3+2NaOH
Na
2SO
3+2NH
3��+2H
2O��Na
2SO
3+H
2SO
4=Na
2SO
4+SO
2��+H
2O
�ʴ�Ϊ������NH
4��
2SO
3+2NaOH
Na
2SO
3+2NH
3��+2H
2O��Na
2SO
3+H
2SO
4=Na
2SO
4+SO
2��+H
2O
��3�������£���pH=a��NH
3��ˮ��Һ�м�������pH=b��HNO
3��ˮ��Һ����a+b=14����ַ�Ӧ����Һ�и�������Ũ���ɴ�С��˳���ǣ�pH=a��NH
3��ˮ��Һ��C��OH
-��=
=10
-14+amol/L
pH=b��HNO
3��ˮ��ҺC��H+��=10
-bmol/L��a+b=14������C��OH
-��=10
-14+amol/L=10
-bmol/L��C��H
+��=C��OH
-���������Ϻ�Ӧ��һˮ�ϰ���������Һ�е�����Ũ�ȴ�Сc��NH
4+����c��NO
3-����c��OH
-����c��H
+����
�ʴ�Ϊ��c��NH
4+����c��NO
3-����c��OH
-����c��H
+��
��4�������ݼ���4molH��2molY��Ӧ���ﵽƽ��ų�354KJ�����������㷴Ӧ�ﵽƽ������ĵ�Y���ʵ���=
��1mol=1.8mol����ѧƽ�������ʽ������ʽ���㣻
2H��g��+Y��g��?2I��g������H=-196.6KJ/mol��
��ʼ����mol�� 4 2 0
�仯����mol�� 3.6 1.8 3.6
ƽ������mol�� 0.4 0.2 3.6
ƽ���Y��ת����=
��100%=90%
��ѹǿ�㶨���ܱ�������ƽ����ϵ�У��ټ���wmol��̬��I���ʣ�ƽ�������ƶ����¶ȡ�ѹǿ�㶨���ܱ��������൱���ּ���wmolH��0.5wmolY��Ӧ��
��ʼ���������ȣ���ѧƽ���Ч��H �İٷֺ�����ͬ����������ƽ����㣬���ʱת����HΪY��
2H��g��+Y��g��?2I��g������H=-196.6KJ/mol��
��ʼ����mol�� w 0.5w 0
�仯����mol�� y 0.5y y
ƽ������mol�� w-y 0.5��w-y�� y
��H���=
��100%=
��100%�õ�Y=0.9W
���Դﵽƽ���H�����ʵ���=0.4mol+w-0.9w=0.4+0.1w��
�ʴ�Ϊ��0.4+0.1w


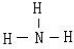


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�