
【题目】在一定温度和压强下,1体积的A2气体和3体积的B2气体变成2体积的C气体,则C的化学式为
A.AB3 B.AB C.A3B D.A2B3
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.物质发生化学变化都伴随着能量变化
B.任何反应中的能量变化都表现为热量变化
C.伴有能量变化的物质变化都是化学变化
D.化合反应都是放热的,分解反应都是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有200 mL H2SO4溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol/L的NaOH溶液, 产生沉淀的量与所加NaOH溶液的体积的关系如下图所示。则原H2SO4物质的量浓度是( )

A.1mol/L B.2mol/L C.3mol/L D.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中所涉及的A、B、C、D、E、F和G等都是中学化学教材中常见物质。其中,B、E为金属单质,D为气体。反应①②是置换反应,反应①②③均在高温下进行。A为常温下最常见的液体,C有磁性,E、F既能溶于NaOH又能溶于HCl。
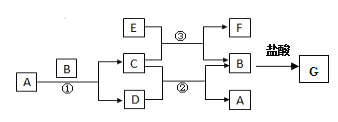
(1)C的化学式 ,C与足量盐酸反应的离子方程式 ;
(2)反应③化学方程式 ;E加入过量的NaOH溶液对应离子反应方程式 ;
(3)G溶液中加入酸性的H2O2溶液后变黄色,对应离子反应方程式 ;
(4)纯净G的溶液中金属阳离子检验方法 ;向G溶液中加入NaOH溶液后的现象是 ;反应的化学方程式为 ;
(5)F与氢氧化钠反应的化学方程式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白磷和红磷都是磷元素的单质,已知31g红磷完全转化成白磷时,要吸收E kJ的能量,下列说法正确的是( )
A.白磷不如红磷稳定
B.等质量时,红磷能量高于白磷
C.红磷转化成白磷不属于化学变化
D.等质量的红磷与白磷完全燃烧,白磷放出的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合物,且体积比为1﹕1,则V可能为
A.9.0L B.13.5L C.15.7L D.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气在工业上有着重要的用途,某兴趣小组在实验室中模拟工业上用氯气制备无水氯化铝(无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾)。可用下列装置制备。


(1)装置B中盛放 溶液,其作用是 。F中的是 溶液,其作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(2)装置A实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末 B.加热 C.往烧瓶中加入浓盐酸
(3)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出很多实验方案,其中方案之一为让残留的液体与足量Zn反应,测量生成的H2体积。装置如右图所示(夹持器具已略去)。
①使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
②反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因是 (排除仪器和实验操作的影响因素)。
(4)该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为-59℃,液体为红色;Cl2沸点为-34℃,液态为黄绿色。设计最简单的实验验证Cl2中含有ClO2 _____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在科学研究和工业生产中具有许多用途。
(1)纳米氧化亚铜(Cu2O)是一种用途广泛的光电材料,已知高温下Cu2O比CuO稳定,
①画出基态Cu原子的价电子轨道排布图_______________;
②从核外电子排布角度解释高温下Cu2O比CuO更稳定的原因_________________;
(2)CuSO4溶液常用作农药、电镀液等,向CuSO4溶液中滴加足量浓氨水,直至产生的沉淀恰好溶解,可得到深蓝色的透明溶液,再向其中加入适量乙醇,可析出深蓝色的Cu(NH3)4SO4·H2O晶体。
①沉淀溶解的离子方程式为_________________________;
②Cu(NH3)4SO4·H2O晶体中存在的化学键有__________;
a.离子键 b.极性键 c.非极性键 d.配位键
③SO42-的立体构型是__________,其中S原子的杂化轨道类型是_____________;

(3)Cu晶体中原子的堆积方式如图所示(为面心立方最密堆积),则晶胞中Cu原子的配位数为__________,若Cu晶体的晶胞参数a=361.4pm,则Cu晶体的密度是________(只用数字列算式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为_____________,其中氮的化合价为____________。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为___________。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2N2H4(l)+ N2O4(l)=3N2(g)+4H2O(g) △H4=- 1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com