


分析 MgCl2、AlCl3的混合溶液与过量氨水反应生成氢氧化镁和氢氧化铝沉淀,再经过过滤、洗涤、干燥得氢氧化镁和氢氧化铝沉淀,再在高温焙烧得到MgAl2O4固体,(1)先加入氨水,再加入盐的混合溶液,会使两种沉淀同时生成;
(2)根据题意可知,沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入硝酸酸化的硝酸银溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净;
(3)根据所给的装置图可知,装置A是实验室利用浓盐酸与二氧化锰反应制取氯气,制得的氯气中有水和氯化氢杂质,氯化铝易水解,所以B中装饱和食盐水是为了除去混有的HCl气体,C中装浓硫酸,干燥氯气,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是用氢氧化钠溶液吸收反应的尾气氯气,所以可以加入碱石灰来代替F和G的作用;
(4)氯气与铝反应生成无水AlCl3(183℃升华),所以氯化铝气体进入E装置前有可能在导管里冷凝成固体,而堵塞导管.
解答 解:MgCl2、AlCl3的混合溶液与过量氨水反应生成氢氧化镁和氢氧化铝沉淀,再经过过滤、洗涤、干燥得氢氧化镁和氢氧化铝沉淀,再在高温焙烧得到MgAl2O4固体;
(1)如先加入MgCl2、AlCl3的混合溶液,再加氨水,氨水少量,应先生成氢氧化镁沉淀,反之,先加氨水,因氨水足量,则同时生成沉淀,
故答案为:B;
(2)沉淀中应该附着氯离子和铵根离子,若判断是否洗净,可以取少量最后一次洗涤液,加入AgNO3溶液(或硝酸酸性的AgNO3溶液)溶液进行判断,若生成白色沉淀,则说明没有洗涤干净;若没有沉淀生成,则说明已经洗涤干净,高温焙烧固体应在坩埚中进行,
故答案为:AgNO3溶液(或硝酸酸性的AgNO3溶液);坩埚;
(3)根据所给的装置图可知,装置A是实验室利用浓盐酸与二氧化锰反应制取氯气,制得的氯气中有水和氯化氢杂质,氯化铝易水解,所以B中装饱和食盐水是为了除去混有的HCl气体,C中装浓硫酸,干燥氯气,因为氯化铝易发生水解,故应该防止空气中的水蒸气进入E装置,而G是用氢氧化钠溶液吸收反应的尾气氯气,防止污染空气,所以可以加入碱石灰来代替F和G的作用,
故答案为:饱和食盐水;吸收反应的尾气氯气,防止污染空气;碱石灰;
(4)氯气与铝反应生成无水AlCl3(183℃升华),所以氯化铝气体进入E装置前有可能在导管里冷凝成固体,而堵塞导管,
故答案为:D、E之间的导管可能被堵塞而导致发生爆炸事故.
点评 本题考查物质的制备实验设计,涉及实验操作目的、原理、步骤等有关问题,主要考查了实验方案设计中的实验操作,综合考查了学生的实验探究能力,注意(3)F用球形干燥管代替F中可以用碱石灰(或NaOH与CaO混合物),既能吸收尾气氯气,又能防止空气中水蒸气进入E装置,为易错点,题目难度中等.


 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
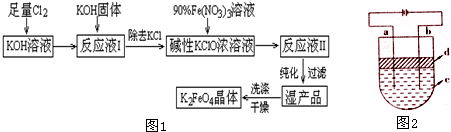
| 湿法 | 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S>I2>Fe3+>Cl2 | B. | Cl2>Fe3+>I2>S | C. | Fe3+>Cl2>S>I2 | D. | Cl2>I2>Fe3+>S |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com