
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ①②③ | C. | ①② | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

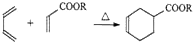

 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$
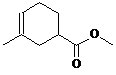 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4LCCl4中含有的分子数目为NA | |
| B. | 7.8gNa2S和Na2O2的混合物中,含有的阴离子数目为0.1NA | |
| C. | 足量的铜与含有0.2molH2SO4的浓溶液共热可生成SO2为0.1NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止催化剂中毒,炉气在进入接触室之前需要净化 | |
| B. | 为提高SO2的转化率,接触室内反应温度选定在400℃~500℃ | |
| C. | 为防止污染大气,从吸收塔出来的尾气常用NaOH溶液吸收 | |
| D. | 为提高SO3的吸收效率,用稀硫酸代替水吸收SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、NO3-、NH4+、Cl- | B. | Ca2+、HCO3-、NH4+、AlO2- | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Na+、NH4+、SO42-、K+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com