
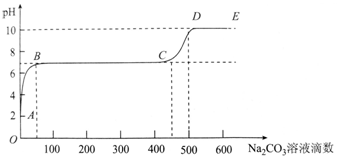
| A. | 开始时溶液pH=2是因为残留液中还有盐酸剩余 | |
| B. | BC段表示随着碳酸钠溶液的滴入,CaCO3沉淀的质量逐渐增加 | |
| C. | AB发生的反应为:Ca2++CO32-═CaCO3↓ | |
| D. | 滴入500滴碳酸钠溶液后溶液中c(OH-)>c(H+) |
分析 根据图象可知,用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,即A点溶液中含CaCl2和过量的盐酸;
向残留液中加入碳酸钠溶液,则Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,导致溶液的pH升高,即AB段;
在B点时,溶液的pH=7,则此时Na2CO3将盐酸恰好完全反应,即B点溶液中的溶质只有NaCl和CaCl2;
继续滴加碳酸钠溶液,则Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,即BC段,溶液的pH不变;
在C点时,溶液中的CaCl2完全反应,继续滴加碳酸钠溶液,碳酸钠过量,由于碳酸钠为强碱弱酸盐,水解显碱性,故溶液的pH生高,即CD段,据此分析.
解答 解:根据图象可知,用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,即A点溶液中含CaCl2和过量的盐酸;
向残留液中加入碳酸钠溶液,则Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,导致溶液的pH升高,即AB段;
在B点时,溶液的pH=7,则此时Na2CO3将盐酸恰好完全反应,即B点溶液中的溶质只有NaCl和CaCl2;
继续滴加碳酸钠溶液,则Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,即BC段,溶液的pH不变;
在C点时,溶液中的CaCl2完全反应,继续滴加碳酸钠溶液,碳酸钠过量,由于碳酸钠为强碱弱酸盐,水解显碱性,故溶液的pH生高,即CD段.
A、用大理石和稀盐酸制备CO2后的残留液pH=2,溶液显酸性,则说明盐酸剩余,故A正确;
B、BC段溶液的pH不变,是由于Na2CO3和CaCl2反应:Na2CO3+CaCl2=CaCO3↓+2NaCl,离子方程式为:Ca2++CO32-═CaCO3↓,故碳酸钙沉淀的量增多,故B正确;
C、由于残留液中有盐酸剩余,故向残留液中加入碳酸钠溶液,AB段发生Na2CO3和HCl反应:Na2CO3+2HCl=2NaCl+CO2+H2O,离子方程式为:CO32-+2H+=CO2+H2O,故C错误;
D、滴入500滴碳酸钠溶液后,溶液的pH大于7,则c(OH-)>c(H+),故D正确.
故选C.
点评 本题考查了根据图象来分析反应过程,综合性较强,应注意图象提供信息的分析和综合运用,难度适中.


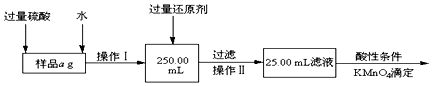
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钠水溶液具有强氧化性,故可用作消毒剂 | |
| B. | 氢氟酸能蚀刻玻璃,是利用氢氟酸的弱酸性 | |
| C. | 常温下,铝能被浓硫酸钝化,可用铝罐贮运浓硫酸 | |
| D. | 锅炉水垢中含有的CaSO4,可先用Na2CO3溶液处理,后用酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
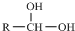 $\stackrel{-H_{2}O}{→}$
$\stackrel{-H_{2}O}{→}$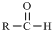 请根据如图回答:
请根据如图回答: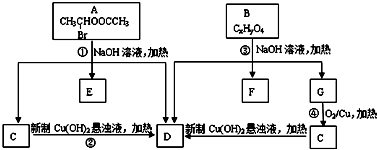
 .
. ;
; .
.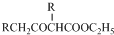 +C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).
+C2H5OH,请以G为唯一有机试剂合成乙酰乙酸乙酯(CH3COCH2COOC2H5),设计合成路线(其他试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)>NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com