
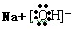 ,含有化学键的类型离子键、极性键;
,含有化学键的类型离子键、极性键; 分析 A、B、C、D、E是原子序数依次增大的五种元素,B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,说明含有两性氢氧化物,根据B、C、D同周期可判断B为Na元素,C为Al元素,D的原子半径是同周期原子屮最小的,D为Cl元素,E元素位于笫四周期第8纵行,故E为Fe元素,A、D同主族,则A为F,再结合物质结构、性质解答.
解答 解:A、B、C、D、E是原子序数依次增大的五种元素,B、C、D的最高价氧化物的水化物均能互相反应生成盐和水,说明含有两性氢氧化物,根据B、C、D同周期可判断B为Na元素,C为Al元素,D的原子半径是同周期原子屮最小的,D为Cl元素,E元素位于笫四周期第8纵行,故E为Fe元素,A、D同主族,则A为F,
(1)根据上面的分析可知,D为Cl元素,D元素的名称是氯,
故答案为:氯;
(2)D为Cl元素,元素D在元素周期表中的位置是第三周期第VIIA族,
故答案为:第三周期第VIIA族;
(3)电子层数相同的离子,核电荷数越多,半径越小,所以A、B、C形成的单核离子中,离子半径从大到小的顺序为F->Na+>Al3+,
故答案为:F->Na+>Al3+;
(4)①氢氧化铝和高氯酸之间反应的离子方程式为Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O;
②氢氧化铝和氢氧化钠之间反应的化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(5)B的最高价氧化物的水化物为氢氧化钠,其的电子式为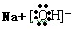 ,含有化学键的类型为离子键、极性键,
,含有化学键的类型为离子键、极性键,
故答案为: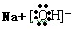 ;离子键、极性键;
;离子键、极性键;
(6)由于Fe2+能被氧化成Fe3+,遇KSCN溶液显红色,所以Fe2+的检验方法为向溶液中先加入KSCN溶液,溶液不变色,然后在向其中加入H2O2(或通入Cl2),若溶液变红色,则证明是Fe2+,
故答案为:向溶液中先加入KSCN溶液,溶液不变色,然后在向其中加入H2O2(或通入Cl2),若溶液变红色,则证明是Fe2+.
点评 本题考查了元素位置结构性质的相互关系及应用,涉及元素推断、电子式、离子方程式、化学键,离子的检验等知识点,根据原子结构、物质性质确定元素,再结合均摊法、元素周期律等知识点来分析解答,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学电池的反应本质是氧化还原反应 | |
| B. | 最早使用的化学电池是锌锰电池 | |
| C. | 最早使用的充电电池是铅蓄电池 | |
| D. | 二次电池的放电反应与充电反应可能是可逆反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应中一定有新物质生成,同时必有能量的释放 | |
| B. | 在化学反应中一定有新物质生成,但不一定有能量的变化 | |
| C. | 在化学反应中一定有化学键的变化 | |
| D. | 在化学反应中一定有化学键的变化,但不一定有能量的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用浓氨水和氢氧化钠制取氨气 | |
| B. | 加热蒸干AlCl3溶液不能得到无水AlCl3 | |
| C. | 工业上SO2和O2在常压下生成SO3 | |
| D. | 水中的c(H+)比0.1mol/LNaOH溶液中的c(H+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等体积的O2和N2中的分子数相等 | |
| B. | 等温等压的NO和CH4中的分子数相等 | |
| C. | 20℃等压等体积的O2和O3中的分子数相等 | |
| D. | 等压的N2和CO2中的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
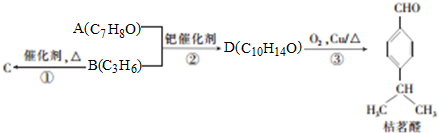
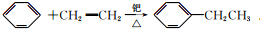 .
.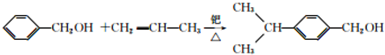 .
.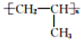 .
.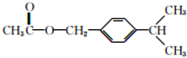 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的价电子数和族序数相等 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | IA、IIB族的元素属于S区元素 | D. | [Cu(NH3)4]2+离子中的配位键数为3. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com