
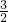 =1.5mol,
=1.5mol,

科目:高中化学 来源:2013届河北省冀州中学高三一轮检测化学试卷(带解析) 题型:单选题
用NA代表阿伏加德罗常数,下列说法正确的是( )
| A.常温下,2LpH=12的Na2CO3溶液中含有的OH—数目为0.02NA |
| B.5.6gFe粉在0.1molCl2中充分燃烧,转移电子数为0.3NA |
| C.将100mL 1mol/LFeCl3溶液滴入沸水中,生成胶体粒子0.1NA |
| D.0.1molNa与O2反应生成Na2O和Na2O2时,转移电子数0.2NA |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年河北省高三一轮检测化学试卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,下列说法正确的是( )
A.常温下,2LpH=12的Na2CO3溶液中含有的OH—数目为0.02NA
B.5.6gFe粉在0.1molCl2中充分燃烧,转移电子数为0.3NA
C.将100mL 1mol/LFeCl3溶液滴入沸水中,生成胶体粒子0.1NA
D.0.1molNa与O2反应生成Na2O和Na2O2时,转移电子数0.2NA
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省武汉二中、荆门市龙泉中学联考高一(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省武汉二中、荆门市龙泉中学联考高一(下)期末化学试卷(解析版) 题型:选择题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com