
下列解释事实的离子方程式书写正确的是
A. 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32-
B. 氯化铁溶液吸收有毒的硫化氢气体:Fe3++H2S=2Fe2++S↓+2H+
C. SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O═BaSO3↓+2H+
D. 84消毒液和洁厕灵混合使用会产生有毒气体:5Cl-+ClO3-+6H+=3Cl2↑+3H2O
科目:高中化学 来源:2017届河南省郑州、平顶山、濮阳市高三第二次质量预测(二模)理综化学试卷(解析版) 题型:简答题
氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,在潮湿空气中易水解氧筑化,且在氯离子浓度较大的体系中存在CuCl+Cl-=[CuCl2]-。工业上用低品铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如下:
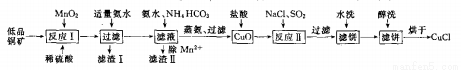
回答下面问题:
(1)反应I中被氧化的元素有_________。(填元素符号)
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离于方程式_________。
(3)写出反应II中发生反应的离子方程式_________。
(4)在进行反应II时,通入的SO2一般都要适当过量,目的是_________。
(5)滤饼进行醇洗的目的是_________。
(6)在进行反应II时,当氯化钠用量增加到一定程度后氯化亚铜的沉淀率减小,原因是_________。
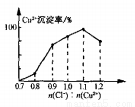
(7)Cu2+的沉淀率是指转化为CuCl的n(Cu2+)占总的n(Cu2+)的百分比。在一定条件下Cu2+沉淀率与沉淀前的Cl-、Cu2+的物质的量之比[n(Cl-): n(Cu2+)]的关系如下图所示。CuCl+Cl- [CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
[CuCl2]-的平衡常数K=6.5×10-2,则该条件下Cu2+的最大沉淀率为_________。(保留两位小数)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高一下学期第一次月考理科综合化学试卷(解析版) 题型:填空题
下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 _________________。
(2)由表中两种元素的原子按1:1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号)____。
a.MnO2 b.KMnO4 c.Na2SO3
(3)④、⑦、⑩的原子半径由大到小的顺序 __________________(填元素符号) 。
(4)④、⑦的氢化物的稳定性最强的是 __________(填化学式)。
(5)⑨元素单质与水反应的离子方程式是 ______________________________。
(6)设计实验方案:比较⑦与⑩单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
________ | ________ |
查看答案和解析>>
科目:高中化学 来源:2017届河南省豫南九校高三下学期质量考评七理综化学试卷(解析版) 题型:选择题
下列操作不能达到目的的是
选项 | 目的 | 操作 |
A | 配制100mL1.0mol/LCuSO4溶液 | 将25.0gCuSO4·5H2O溶于100mL蒸馏水中 |
B | 除去NaCl固体中少量的Na2CO3 | 将混合物溶于水,再加入稍过量的盐酸,再加热蒸发结晶 |
C | 使Na2SO3溶液中的SO32-完全转化为SO42- | 向Na2SO3溶液中加入过量的H2O2溶液 |
D | 确定KI溶液中的碘离子是否被部分氧化 | 取少量溶液于试管中,向其中滴加少量淀粉溶液,观察溶液是否变蓝色,再另取少量溶液滴加AgNO3溶液,观察溶液是否产生黄色沉淀 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2017届黑龙江省哈尔滨市高三二模理科综合化学试卷(解析版) 题型:填空题
硫的多种化合物在工业中有重要应用。
(1)Na2S2可以做制革工业中原皮的脱毛剂,写出Na2S2的电子式______________。
(2)连二亚硫酸钠(Na2S2O4)又称保险粉,可作木浆造纸的漂白剂,其水溶液性质不稳定,有极强的还原性。
①Na2S2O4中S元素的化合价为_____________
②将甲酸(HCOOH)和NaOH溶液混合,再通入SO2气体,会得到保险粉,此时甲酸被氧化为CO2,该反应的化学方程式为_________________。
③Na2SO4暴露于空气中易吸收氧气和水蒸气而变质,发生反应时,当氧化剂和还原剂的物质的量之比为1:2时,反应的化学方程式为____________。
(3)铬会造成环境污染,某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+,再调节pH至8,使铬元素沉降,分离出污泥后测得废水中Cr3+浓度为0.52mg/L,达到排放标准。
①写出Na2SO5参加反应的离子方程式_______________________。
②处理后的废水中Cr3+的物质的量浓度为____________________。
(4)氢硫酸和亚硫酸是两种弱酸,回答下列问题
①0.1mol/L H2SO4与0.2mol/L H2S溶液等体积混合,所得溶液中S2-浓度为_____mol/L。(已知氢硫酸Ka1=1.0×10-8、Ka2=1.0×10-15,忽略H2S和H2O电离产生的H+)
②已知亚硫酸的Ka1=1.0×10-2、Ka2=6.0×10-13,设计实验证明亚硫酸第一步不完全电离。(可用实验用品:0.1mol/L亚硫酸、0.1mol/L NaHSO3溶液、0.1mol/L Na2SO3溶液,广泛pH试纸、pH计)
操作简述 | ______________ |
现象或数据 | ______________ |
结论 | H2SO3第一步不完全电离 |
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:填空题
氨在国民经济中占有重要地位。
I.合成氨工业中,初始时氮气、氢气的体枳比为1:3时,每反应1mol N2,放出92.2kJ热量。
(1)工业合成氨的热化学方程式是_________________。
(2)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,平衡混合物中氨的体积分数。
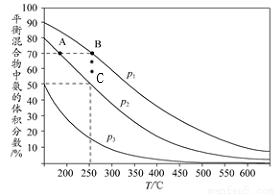
①由图可知:p1、p2、p3的大小关系为____________,理由是___________________。
②A、B点生成氨气的速率大小关系为____________________。B、C点,合成氨反应的化学平衡常数大小关系为__________,C点,N2的转化率为_____。③下列关于合成氨的说法正确是______(填序号)。
A.断开1个N=N键的同时有6个N—H键形成,反应一定达到平衡状态
B.混合气体的平均相对分子质量不再改变状态,反应一定达到平衡状态
C.由于△H<0、△S>0,故合成氨反应一定能自发进行
D.增大n(N2):n(H2)的比值,有利用提离H2的转化率
II.最近美国Simons等科学家发明了不必使氨先裂化为氢就可直接用于燃料电池的方法。其电池反应为4NH3+3O2==2N2+6H2O,你认为电解质溶液应显_______(填“酸性”“中性”或“碱性”),写出负极的电极反应式:_________。若电池产生的电流为1A,反应时间为1小时,氨气的转化率为80%,则最低需要______mol氨气(列出计算式即可,已知一个电子的电量是1.6×10-19C)。
查看答案和解析>>
科目:高中化学 来源:2017届重庆市高三适应性月考(六)理综化学试卷(解析版) 题型:选择题
生活中常见的荧光棒的发光原理可用图表示:

荧光染料分子获取上述反应产生的能量后释放出荧光。下列说法正确的是
A. 苯酚苯环上的二氯代物共有6种
B. 苯酚上的所有原子一定共平面
C. 荧光棒发光过程涉及光能到化学能的转化
D. 二苯基草酸酯与草酸( )互为同系物
)互为同系物
查看答案和解析>>
科目:高中化学 来源:2017届贵州省贵阳市高三下学期第六次适应性考试理综化学试卷(解析版) 题型:推断题
U、V、W、X、Y、Z是原子序数依次增大的短周期元素。已知:
①WU4++XU-==WU3+U2X,各种反应物和生成物的电子总数都与Y+相等;
②Z的单质在X2中燃烧的产物可使品红溶液褪色;
③V的单质在X2中燃烧可生成VX和VX2两种气体;
④Y的单质是一种金属,该金属与X2反应可生成Y2X和Y2X2两种固体。
请回答下列问题:
(1)写出Y2X2与水反应的化学方程式:________________。
(2)V、W、X形成的10电子氢化物中,沸点最高的是__________(写化学式)。
(3)U2X2与FeSO4按物质的量之比1:2溶于稀硫酸中,反应的离子方程式为__________。
(4)常温下,向pH=11的Y2VX3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________。
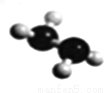
(5)已知由U、W两种元素组成的共价化合物联氨的球棍模型如图所示,则联氨分子的电子式为____________。联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为_______(已知:N2H4+H+==N2H5+的K=8.7×107;KW=1.0×10-14)。联氨与过量硫酸形成的酸式盐的化学式为______________。
查看答案和解析>>
科目:高中化学 来源:2017届湖南省长沙市高三(实验班)第十次月考理综化学试卷(解析版) 题型:选择题
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸常共存在一起,其结构简式如图所示。下列说法正确的是

A. 奎宁酸与莽草酸互为同分异构体
B. 两种酸含有的官能团完全相同
C. 两种酸均能发生加成反应、聚合反应和取代反应
D. 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为5:4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com