
【题目】青铜(Cu-Zn)是我国最早大量使用的合金,其中锌是现代工业上常用金属。某废催化剂含58.2%的SiO2(不溶于水和稀酸)、21.0%的ZnO、4.5%的ZnS(不溶于水但溶于稀酸)和12.8%的CuS(不溶于水也不溶于稀酸)。某同学用15.0 g该废催化剂为原料,以稀硫酸和H2O2为试剂,回收其中的锌和铜。
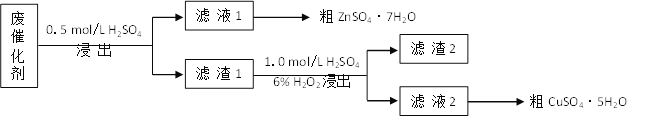
(1)第一次浸出时发生的反应化学方程式是__________。
(2)滤渣2是__,第二次浸出发生的反应离子方程式是________。
(3)从滤液1、滤液2中分别得到粗ZnSO4·7H2O、粗CuSO4·5H2O的操作均是____、过滤、洗涤、干燥。
(4)某同学在实验完成之后,得到1.5gCuSO4·5H2O(M=250 g·mol–1),则铜的回收率为_____。
【答案】ZnO + H2SO4 = ZnSO4 + H2O, ZnS + H2SO4 = ZnSO4 + H2S↑ SiO2 CuS + 4H2O2 = Cu2+ + SO42– + 4H2O 加热浓缩、冷却结晶 30%
【解析】
废催化剂加入稀硫酸,第一次浸出主要发生反应:ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑、Fe3O4+4H2SO4=FeSO4+Fe2(SO4)3+4H2O,过滤后滤液中ZnSO4、FeSO4、Fe2(SO4)3,浓缩结晶得到粗ZnSO47H2O,滤渣1含有SiO2、CuS,向盛有滤渣1的反应器中加H2SO4和H2O2溶液,发生氧化还原反应,生成硫酸铜、硫,滤渣2含有硫和二氧化硅,滤液含有硫酸铜,经浓硫酸结晶可得到硫酸铜晶体,据此分析解答。
(1)第一次浸出主要发生的反应化学方程式是ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑,故答案为:ZnO+H2SO4=ZnSO4+H2O、ZnS+H2SO4=ZnSO4+H2S↑;
(2)根据上述分析可知滤渣2含有硫和二氧化硅,第二次浸出时发生反应:CuS+H2O2+H2SO4=CuSO4+S+2H2O,故答案为:SiO2、S;CuS+H2O2+H2SO4=CuSO4+S+2H2O;
(3)从滤液1、滤液2中分别得到粗ZnSO4·7H2O、粗CuSO4·5H2O的操作均为溶液结晶得到含结晶水的晶体,则均采用蒸发浓缩、冷却结晶,然后过滤、洗涤、干燥获得晶体,故答案为:加热浓缩、冷却结晶;
(4)15.0 g该废催化剂中含有12.8%的CuS,其中Cu的物质的量为![]() =0.02mol,1.5g CuSO4﹒5H2O中Cu的物质含量的为
=0.02mol,1.5g CuSO4﹒5H2O中Cu的物质含量的为![]() =0.006mol,则铜的回收率为
=0.006mol,则铜的回收率为![]() ×100%=30%,故答案为:30%。
×100%=30%,故答案为:30%。


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】有效去除大气中的NOx,保护臭氧层,是环境保护的重要课题。
(1)在没有NOx催化时,O3的分解可分为以下两步反应进行;
①O3=O+O2 (慢) ②O+O3=2O2 (快)
第一步的速率方程为v1=k1c(O3),第二步的速率方程为v2=k2c(O3)·c(O)。其中O为活性氧原子,它在第一步慢反应中生成,然后又很快的在第二步反应中消耗,因此,我们可以认为活性氧原子变化的速率为零。请用k1、k2组成的代数式表示c(O)=____________。
(2)NO做催化剂可以加速臭氧反应,其反应过程如图所示:
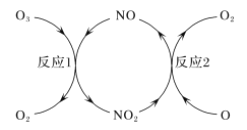
已知:O3(g)+O(g)=2O2(g) ΔH=-143 kJ/mol
反应1:O3(g)+NO(g)=NO2(g)+O2(g) ΔH1=-200.2 kJ/mol。
反应2:热化学方程式为____________________________。
(3)一定条件下,将一定浓度NOx(NO2和NO的混合气体)通入Ca(OH)2悬浊液中,改变![]() ,NOx的去除率如图所示。
,NOx的去除率如图所示。
已知:NO与Ca(OH)2不反应;

NOx的去除率=1-![]() ×100%
×100%
①![]() 在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
在0.3-0.5之间,NO吸收时发生的主要反应的离子方程式为:___________。
②当![]() 大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
大于1.4时,NO2去除率升高,但NO去除率却降低。其可能的原因是__________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8 kJ/mol,反应达到平衡时,N2的体积分数随![]() 的变化曲线如图。
的变化曲线如图。
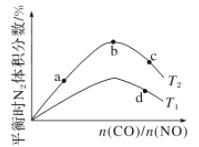
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________(以上两空均用a、b、c、d表示)。
③若![]() =0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
=0.8,反应达平衡时,N2的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是H2 和Cl2 反应生成HCl的能量变化示意图,由图可知( )
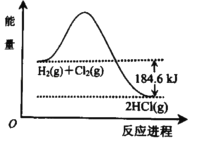
A. 反应物的能量总和小于生成物的能量
B. 生成1molHCl(g)需吸收92.3kJ的能量
C. H2(g)+Cl2(g)=2HCl(g)△H=﹣184.6 kJmol﹣1
D. H2(g)+Cl2(g)=2HCl(g)△H=﹣184.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学中常用的物理量,请完成以下有关内容。
(1)咖啡含有咖啡因(化学式为C8H10N4O2),则咖啡因的摩尔质量为__________g/mol。
(2)0.2 g H2大约含有________个H原子。
(3)100 mL某Al2(SO4)3溶液中,c(Al3+)=2.0 mol/L,其中c(SO42-)= ________mol/L。
(4)8 克O2和O3的混合气体中氧原子的物质的量为 ________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置所示的实验中,能达到实验目的的是( )
|
|
A. 制备 | B. 比较 |
|
|
C. 铝热法制备少量铁单质 | D. 排水法收集氢气 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
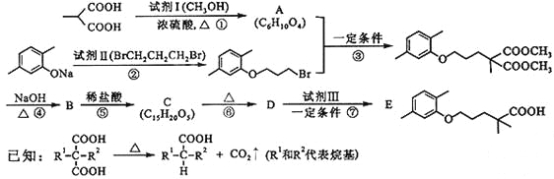
【题目】高血脂严重影响人体健康,化合物E是一种临床治疗高血脂症的药物。E的合成路线如下(部分反应条件和试剂略):
请回答下列问题:
(1)试剂Ⅰ的名称是___a___,试剂Ⅱ中官能团的名称是___b___,第② 步的反应类型是____c___。
(2)第①步反应的化学方程式是_____________。
(3)第⑥步反应的化学方程式是_____________。
(4)第⑦步反应中,试剂Ⅲ为单碘代烷烃,其结构简式是_________ 。
(5)C的同分异构体在酸性条件下水解,生成X、Y和CH3(CH2)4OH。若X含有羧基和苯环,且X和Y的核磁共振氢谱都只有两种类型的吸收峰,则X与Y发生缩聚反应所得缩聚物的结构简式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了研究“干燥的CO2不能与Na2O2反应”和“CO2在有水存在时才能与Na2O2反应”,设计了如下实验装置:

(1)如图装置,在干燥管中装入Na2O2后,打开活塞加入稀硫酸,生成CO2。打开K1,关闭K2,加热铜丝,目的是_____,X是_____。实验观察到铜丝未变化,则得出结论______。
(2)若打开K2,关闭K1,出现________现象,可证明有水时CO2与Na2O2反应产生了O2。
(3)根据以上的实验结论,写出生成CO2、O2反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)右图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。
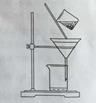
a. 漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备
CaCO![]() 滤液
滤液![]()
![]() 白色晶体
白色晶体
(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com