
下列关于氧化还原反应的说法正确的是
A.任何化合物既有氧化性又有还原性
B.金属单质只有还原性,非金属单质只有氧化性
C.根据氯气与水的反应可推出氧化性:Cl2强于HClO
D.硫与KOH溶液反应,被氧化的硫与被还原的硫物质的量之比为2:1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届湖南省衡阳市五校高三11月联考化学试卷(解析版) 题型:选择题
已知:3Fe2++ NO3-+4H+= 3Fe3++ NO↑+2H2O,对于该反应的下列叙述中,不正确的是
A.氧化剂和还原剂的物质的量之比为1∶3
B.离子间的反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO3-发生氧化反应,转移3 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+- e-=Fe3+
查看答案和解析>>
科目:高中化学 来源:2015届湖南省益阳市高三上学期第三次模拟考试化学试卷(解析版) 题型:选择题
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol·L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示。则下列说法不正确的是
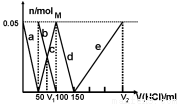
A.M点时生成的CO2为0mol
B.原混合溶液中的CO32-与AlO2-的物质的量之比为1:2
C.V1:V2=1:4
D.a曲线表示的离子方程式为:AlO2-+H+ + H2O=Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月月考化学试卷(解析版) 题型:填空题
(10分)分子筛是一种具有立方晶格的硅铝酸盐化合物。分子筛具有均匀的微孔结构,它的孔穴直径大小均匀,这些孔穴能把比其直径小的分子吸附到孔腔的内部,并对极性分子和不饱和分子具有优先吸附能力,因而能把极性程度不同,饱和程度不同,分子大小不同及沸点不同的分子分离开来,即具有“筛分”分子的作用,故称分子筛。由于分子筛具有吸附能力高,热稳定性强等其它吸附剂所没有的优点,使得分子筛获得广泛的应用。某种型号的分子筛的工业生产流程可简单表示如下:

在加NH3? H2O调节pH的过程中,若pH控制不当会有Al(OH)3生成,假设生产流程中铝元素和硅元素均没有损耗,钠原子的利用率为10℅。
(1)分子筛的孔道直径为 称为4A型分子筛,当Na+被Ca2+取代时就制得5
称为4A型分子筛,当Na+被Ca2+取代时就制得5 型分子筛,当Na+被K+取代时就制得3
型分子筛,当Na+被K+取代时就制得3 型分子筛。要高效分离正丁烷(分子直径为4.65
型分子筛。要高效分离正丁烷(分子直径为4.65 )和异丁烷(分子直径为5.6
)和异丁烷(分子直径为5.6 )应该选用 型分子筛
)应该选用 型分子筛
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为 。
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要为 。
(4)该生产流程中所得分子筛的化学式为 。
(5)加NH3·H2O调节pH后,加热到900C并趁热过滤的原因可能是 .
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月月考化学试卷(解析版) 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种元素,其中A与C可形成化学式为A2C,A2C2的化合物,D的最高价氧化物对应水化物呈强碱性,B与E可形成直线型分子且每个原子最外层都满足8电子稳定结构,则下列说法正确的是
A.原子半径:D>E>B>C>A
B、工业上制取单质D是采用电解D的熔融氧化物
C.D与E形成的化合物溶于水呈弱酸性
D.C与D形成的化合物与D、E形成的化合物,化学键类型一定相同
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月月考化学试卷(解析版) 题型:选择题
NA为阿伏伽德罗常数,下列说法正确的是
A.标准状况下,22.4L CO2与CO的混合气体中含有3NA个氧原子
B.0. 1 mol/L的Na2CO3溶液中含有OH— 数小于0.1NA
C.1 mol乙醇中所含有的共用电子对数目比44g乙醛多2NA
D.足量的锌与一定量的浓硫酸反应生成1 mol气体时,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源:2015届湖南省名校高三第二次联考化学试卷(解析版) 题型:选择题
汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3 =K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75mol,则下列判断正确的是
A.生成40.0LN2(标准状况) B.有0.250molKNO3被氧化
C.转移电子的物质的量为1.25mol D.被氧化的N原子的物质的量为3.5mol
查看答案和解析>>
科目:高中化学 来源:2015届湖南省高三10月第二次阶段考试试卷(解析版) 题型:填空题
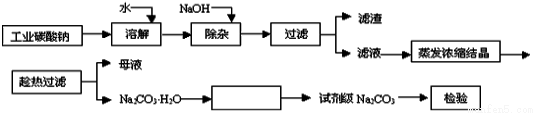
(12分)碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO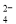 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:
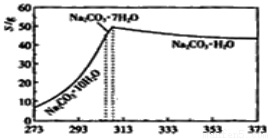
回答下列问题:
(1)滤渣的主要成分为_________________________。
(2)“趁热过滤”的原因是______________________。
(3)在实验室做Na2CO3·H2O脱水实验,判断其脱水完全的方法是:__________。
(4)生产过程中“母液”____(填“能”或“不能”)循环使用。若不能,其原因是:_________。
(5)已知:① Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g);ΔH1= +532.36 kJ·mol-1
② Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g);ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源:2015届湖北黄冈蕲春县第一高级中学高二下期中考试化学卷(解析版) 题型:填空题
(14分)肉桂酸异戊酯G(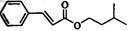 )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:
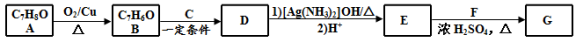
已知以下信息:
① ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3︰1的为 (写结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com