
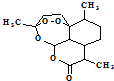
 ,有关叙述正确的是d(选填序号).
,有关叙述正确的是d(选填序号).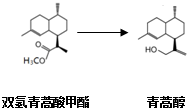
| 物质 | 性质 |
| 双氢青蒿酸甲酯(C16H28O2) | 固体,难溶于水,易溶于有机溶剂. |
| 青蒿醇(C15H28O) | 固体,难溶于水,易溶于有机溶剂. |
| 乙醚 | 无色液体,微溶于水;密度0.71g/cm3;沸点:34.6℃. |
| 氢化铝锂 | 固体,溶于乙醚. 与水反应:LiAlH4+4H2O→Al(OH)3↓+LiOH+4H2↑ 可将一分子酯还原成二分子醇,自身生成醇铝、醇锂. (醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇). |

分析 可根据有机物的结构简式判断分子式为C15H22O5,分子中含有-O-O-键,具有强氧化性,含有-COO-,可发生水解反应,含有较多憎水基,难溶于水;
(1)还原剂为LiAlH4,加入足量还原剂,可提高反应物的转化率;因LiAlH4与水反应,且双氢青蒿酸甲酯不溶于水,不用水作溶剂;
(2)反应在常温下进行,因反应放热,且冷凝回流;
(3)该反应有机物的转化率约为96%,所得乙醚溶液中含有醇锂、醇铝、双氢青蒿酸甲酯、氢化铝锂,可先加入盐酸除去醇锂、醇铝以及氢化铝锂,分液后将乙醚层蒸馏,回收乙醚、甲醇.
解答 解:a.根据有机物的结构简式判断分子式为C15H22O5,故a错误;
b.含有酯基,可与氢氧化钠溶液反应,故b错误;
c.含有酯基,不溶于水,故c错误;
d.由结构简式可知含有过氧键,有较强氧化性,故d正确.
故答案为:d;
(1)还原剂为LiAlH4,加入足量还原剂,可提高反应物的转化率;因LiAlH4与水反应,且双氢青蒿酸甲酯不溶于水,不用水作溶剂,
故答案为:提高双氢青蒿酸甲酯的转化率;双氢青蒿酸甲酯不溶于水,氢化铝锂会与水反应;
(2)由题给信息可知装置要点为不加热、密闭且冷凝回流、常温水浴,则装置如图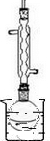 ,故答案为:
,故答案为: ;
;
(3)①因醇铝、醇锂可与盐酸反应,生成铝盐、锂盐和相应的醇,则可先加入盐酸除去醇锂、醇铝以及氢化铝锂,故答案为:盐酸;
②a.为防止防止氢青蒿酸甲酯析出,可在析出晶体后都应有残留液,故答案为:防止氢青蒿酸甲酯析出;
b.为防止乙醚、甲醇挥发而耗损,可用蒸馏的方法,故答案为:方案二可回收乙醚、甲醇.
点评 本题考查有机物制备实验,为高频考点,侧重于学生的分析、实验能力的考查,涉及对装置及操作的分析评价、物质的分离提纯等,难度中等,注意基本操作的使用及常见仪器作用.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
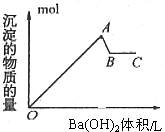
| A. | OA段的反应离子方程式为:2Al3++3SO42-+3Ba2++6OH-→2Al(OH)3↓+3BaSO4↓ | |
| B. | AB段的离子方程式只有:Al(OH)3+OH-→AlO2-+2H2O | |
| C. | A点的沉淀为Al(OH)3和BaSO4的混合物 | |
| D. | B点溶液为KAlO2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Kw>1×10-14 | B. | 水电离的c(H+)>1×10-13 mol/L | ||
| C. | pH>13 | D. | c(OH-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | S2-+Cu2+→CuS↓ | B. | 2HS-+Cu2+→CuS↓+2H++S2- | ||
| C. | HS-+Cu2+→CuS↓+H+ | D. | 2HS-+Cu2+→CuS↓+H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol 任何物质所含的分子数均为NA | |
| B. | 14 g氮气所含的氮原子数为NA | |
| C. | 标准状况下,22.4 L水所含的水分子数为NA | |
| D. | 在钠与氯气的反应中,1 mol钠失去电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=b | B. | HA与BOH的电离常数相等 | ||
| C. | 混合溶液中,c(H+)=$\sqrt{{K}_{W}}$mol/L | D. | 混合溶液中,c(H+)+c(B+)═c(OH-)+c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
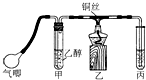 利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).
利用如图装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com